题目内容
1.A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA3型分子.B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小.据此回答下列问题:
(1)写出D元素在元素周期表中的位置是第四周期第ⅠA族;
(2)B与D所形成的化合物电子式为
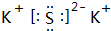 ;
;(3)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,产生淡黄色沉淀,其反应的化学方程式为Cl2+K2S=2KCl+S↓,该反应的氧化产物是S.
(4)实验室里除去BA2气体,可用下列试剂中的AC(填字母)
A.酸性高锰酸钾溶液 B.浓硫酸 C.NaOH溶液 D.品红溶液.
分析 A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,故D为K、C为Cl,据此解答.
解答 解:A、B、C、D是原子序数均小于20的四种元素.A与B同主族,且能形成BA3型分子,则A为氧元素、B为硫元素;B、C、D所形成的简单离子电子层结构相同,核外电子数为18,且B、C、D离子半径依次减小,则原子序数D>C>B,故D为K、C为Cl.
(1)D为K元素,在元素周期表中的位置是:第四周期第ⅠA族,故答案为:第四周期第ⅠA族;
(2)B与D所形成的化合物为K2S,电子式为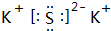 ,故答案为:
,故答案为: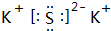 ;
;
(3)将氯气的水溶液滴加到K2S的水溶液中,产生淡黄色沉淀,生成硫,氯气被还还原,同时生成KCl,反应的化学方程式为:Cl2+K2S=2KCl+S↓,氧化产物为S,故答案为:Cl2+K2S=2KCl+S↓;S;
(4)实验室里除去SO2气体,二氧化硫具有还原性,可以用酸性高锰酸钾氧化除去,属于酸性氧化物,可以用氢氧化钠溶液吸收,浓硫酸不能吸收二氧化硫,品红溶液可以鉴别二氧化硫,故选:AC.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.化学是以实验为基础的科学,下列有关实验现象描述不正确的是( )
| 选项 | 实验操作 | 实验现象 |
| A | 在氧气中点燃Mg条 | 发出耀眼白光,生成白色固体 |
| B | 将乙烯通入酸性高锰酸钾溶液 | 溶液褪色 |
| C | 将点燃的Na块伸入Cl2瓶中 | Na块剧烈燃烧,生成大量黑烟 |
| D | 将碘水滴到新切的土豆片上 | 土豆片表面变蓝 |
| A. | A | B. | B | C. | C | D. | D |
9.如表所示是元素周期表示意图的一部分,根据表中10种元素,用元素符号或化学式填空.
(1)①~⑩元素中,金属性最强的是K(填元素符号,下同);化学性质最不活泼是Ar.
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是Al(填元素符号),该水化物与NaOH溶液反应的离子方程式为Al (OH)3+OH-=AlO2-+2H2O.
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的元素是Cl(填元素符号,下同),碱性最强的元素是K.
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是S2->Cl->K+>Ca2+.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | O |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ | ⑨ | ⑩ |
(2)①~⑩元素中,最高价氧化物对应的水化物呈两性的元素是Al(填元素符号),该水化物与NaOH溶液反应的离子方程式为Al (OH)3+OH-=AlO2-+2H2O.
(3)①~⑩元素中,最高价氧化物对应的水化物的酸性最强的元素是Cl(填元素符号,下同),碱性最强的元素是K.
(4)⑤、⑥、⑧、⑨所形成的简单离子的半径由大到小的顺序是S2->Cl->K+>Ca2+.
6.根据有机化合物的系统命名法,下列命名正确的是( )
| A. | 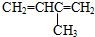 3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 | B. |  2-羟基丁烷 2-羟基丁烷 | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. |  邻羟基苯甲酸 邻羟基苯甲酸 |
13.下列说法正确的是( )
| A. | 最外层有4个电子的原子都是非金属原子 | |
| B. | 同一主族的两种元素的原子序数之差不可能是44 | |
| C. | COCl2分子和CCl4分子中所有原子都满足最外层8电子结构 | |
| D. | 同主族金属的原子,半径越大,熔点越高 |
10.胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统.实验测得:101kPa时,H2的燃烧热为285.8kJ•mol-1,CH4的燃烧热为890.3kJ•mol-1.下列热化学方程式书写正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445.15 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
11.向盛有H2O2的试管中滴入一定量浓盐酸,有刺激性气味的气体生成.经实验证明该气体只含有O2、Cl2、HCl和水蒸气.将气体通入X溶液(如下图),依据观察到的现象,能判断气体中含有Cl2的是( )
| X溶液 | 现象 | 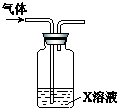 | |
| A | 紫色石蕊溶液 | 溶液先变红后褪色 | |
| B | 淀粉KI酸性溶液 | 溶液变为蓝色 | |
| C | 滴有KSCN的FeSO4溶液 | 溶液变为红色 | |
| D | 稀HNO3酸化的AgNO3溶液 | 有白色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |

 .
. .
.