题目内容
9.化学是以实验为基础的科学,下列有关实验现象描述不正确的是( )| 选项 | 实验操作 | 实验现象 |
| A | 在氧气中点燃Mg条 | 发出耀眼白光,生成白色固体 |
| B | 将乙烯通入酸性高锰酸钾溶液 | 溶液褪色 |
| C | 将点燃的Na块伸入Cl2瓶中 | Na块剧烈燃烧,生成大量黑烟 |
| D | 将碘水滴到新切的土豆片上 | 土豆片表面变蓝 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Mg燃烧生成MgO;
B.乙烯能被高锰酸钾氧化;
C.钠与氯气反应生成白色固体NaCl;
D.土豆中含淀粉,遇碘变蓝.
解答 解:A.Mg燃烧生成MgO,则观察到发出耀眼白光,生成白色固体,故A正确;
B.乙烯能被高锰酸钾氧化,则观察到高锰酸钾溶液褪色,故B正确;
C.钠与氯气反应生成白色固体NaCl,则观察到Na块剧烈燃烧,生成大量白烟,故C错误;
D.土豆中含淀粉,遇碘变蓝,则观察到土豆片表面变蓝,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应及现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物与实验相结合的训练,题目难度不大.

练习册系列答案
相关题目
20.下列化合物中含有2个手性碳原子的是( )
| A. |  | B. |  | ||
| C. | CH3CH2COOH | D. |  |
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L甲烷中含有的碳氢键数目为2NA | |
| B. | 常温下,1L0.1mol/L的Na2CO3溶液中含有OH-离子数为0.1NA | |
| C. | 常温常压下,28gN2、CO的混合气体中含有N2分子数为0.5NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
4.下列物质属于电解质的是( )
| A. | Cl2 | B. | NH3 | C. | FeSO4 | D. | 蔗糖 |
14.对于常温常压下的22.4LSO2,下列有关说法正确的是( )(NA表示阿伏加德罗常数)
| A. | 物质的量为1mol | B. | 质量大于64g | ||
| C. | 含S原子数目大于NA | D. | 含O原子的物质的量小于2mol |
3.环保部门的技术人员常用草酸(H2C2O4)测定酸性工业废水中MnO4-的浓度.某课题组研究发现:少量的摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]可加快溶液紫红色的褪去.为进一步研究有关因素对该反应速率的影响,探究如下:
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
(2)请写出酸性KMnO4溶液与草酸反应生成CO2的离子方程式:2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
请回答下列问题:
(1)请完成以下表格(表中不要留有空格):
| 实验编号 | 实验目的 | 温度 | 废水样品 | 2.0mLH2C2O4的浓度 |
| ① | 为以下实验作参照 | 273K | 4.0mL | 0.10mol?L-1 |
| ② | 298K | 4.0mL | 0.10mol?L-1 | |
| ③ | 探究浓度对反应速率的影响 | 273K | 0.20mol?L-1 |
2MnO4-+5H2C2O4+6H+═2Mn2++8H2O+10CO2↑.
(3)某课题组对摩尔氏盐[FeSO4?(NH4)2SO4?6H2O]中起加快溶液紫红色褪去的成分提出如下假设,请你完成假设二、假设三:
假设一:SO42- 起催化作用.;
假设二:Fe2+起还原作用或起催化作用;
假设三:NH4+起还原作用或起催化作用.
(4)请你设计实验验证上述假设一是否成立,完成下表中的内容.
| 实验方案(不要求写具体操作过程) | 预期的实验现象和结论 |
| 取等量的废水样品于两支试管中,… |
 ,C:CH3CH2CH2OH,D:
,C:CH3CH2CH2OH,D: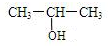 ,E:CH3CH=CH2.
,E:CH3CH=CH2. ;
;