题目内容
3.某羧酸和醇反应生成的酯的相对分子质量为104,则该反应的反应物可能是( )| A. |  和C2H5OH 和C2H5OH | B. | 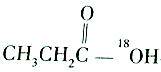 和C2H518OH 和C2H518OH | ||
| C. | 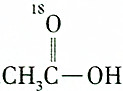 和CH3CH2CH218OH 和CH3CH2CH218OH | D. | 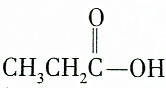 和C2H5OH 和C2H5OH |
分析 酯化反应中“酸脱羟基醇脱氢”,依据酯化反应的原理写出生成酯的结构简式,然后计算出酯的相对分子质量,再进行判断其相对分子量是否为90,以此解答该题.
解答 解:A.CH3CH2CO18OH和C2H5OH反应生成CH3CH2COOC2H5,相对分子质量为102,故A错误;
B.CH3CH2CO18OH和C2H518OH反应生成CH3CH2CO18OC2H5,相对分子质量为104,故B正确;
C.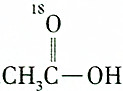 和CH3CH2CH218OH反应生成的酯为CH3C18O18OC3H7,相对分子质量为106,故C错误;
和CH3CH2CH218OH反应生成的酯为CH3C18O18OC3H7,相对分子质量为106,故C错误;
D.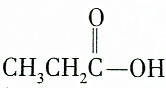 和C2H5OH反应生成的酯为CH3CH2COOC2H5,相对分子质量为102,故D错误.
和C2H5OH反应生成的酯为CH3CH2COOC2H5,相对分子质量为102,故D错误.
故选B.
点评 本题考查了醇与酸发生酯化反应的原理,为高频考点,题目难度不大,明确酯化反应的原理“酸脱羟基醇脱氢”是解题的关键,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
18.下列溶液中,Cl-的物质的量浓度与50ml 1mol/LAlCl3溶液中Cl-物质的量浓度相等是( )
| A. | 100ml 2mol/LFeCl3溶液 | B. | 75ml 1mol/LMgCl2溶液 | ||
| C. | 150ml 3mol/LKCl溶液 | D. | 25ml 2mol/LAlCl3溶液 |
15.下列反应过程中断键和成键能量变化符合下图所示的是( )
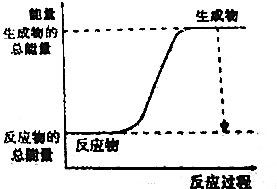

| A. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
1.关于锌银-稀盐酸原电池的叙述,错误的是( )
| A. | 氢离子在银表面被还原,产生气泡 | B. | 银片质量逐渐增大 | ||
| C. | 电子从锌片经导线流向银片 | D. | 锌是负极,其质量逐渐减小 |
2.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期第ⅥA族
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性PH3<H2S<H2O (写氢化物的化学式);
(3)元素⑦的原子结构示意图是 ;
;
(4)写出实验室制取③的氢化物的化学反应方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
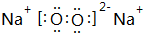
(5)用电子式表示①与⑨反应得到的化合物的形成过程 .
.
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④的名称是氧,元素④在周期表中所处位置第二周期第ⅥA族
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性PH3<H2S<H2O (写氢化物的化学式);
(3)元素⑦的原子结构示意图是
 ;
;(4)写出实验室制取③的氢化物的化学反应方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(5)用电子式表示①与⑨反应得到的化合物的形成过程
 .
. 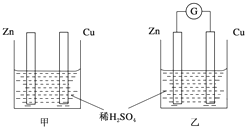 ①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题: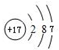 .
. .
.