题目内容
18.下列溶液中,Cl-的物质的量浓度与50ml 1mol/LAlCl3溶液中Cl-物质的量浓度相等是( )| A. | 100ml 2mol/LFeCl3溶液 | B. | 75ml 1mol/LMgCl2溶液 | ||
| C. | 150ml 3mol/LKCl溶液 | D. | 25ml 2mol/LAlCl3溶液 |
分析 Cl-的物质的量浓度与溶液体积大小无关,与溶质浓度及溶质化学式组成有关,50ml 1mol/LAlCl3溶液中Cl-物质的量浓度为:1mol/L×3=3mol/L,据此进行计算.
解答 解:50ml 1mol/LAlCl3溶液中Cl-物质的量浓度为:1mol/L×3=3mol/L,
A.100ml 2mol/LFeCl3溶液中氯离子浓度为2mol/L×3=6mol/L,故A错误;
B.75ml 1mol/LMgCl2溶液中Cl-的物质的量浓度为:1mol/L×2=2mol/L,故B错误;
C.150ml 3mol/LKCl溶液中Cl-的物质的量浓度为3mo/L,故C正确;
D.25mL 2mol/LAlCl3溶液中Cl-的物质的量浓度为:2mol/L×3=6mol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意物质的量与溶液体积大小无关,为易错点,试题培养了学生的化学计算能力.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
8.下列各组物质中,属于同素异形体的是( )
| A. | S2、S4 | B. | 碘晶体、碘蒸气 | ||
| C. | H、D | D. | ${\;}_{8}^{16}$O2、${\;}_{8}^{18}$O2 |
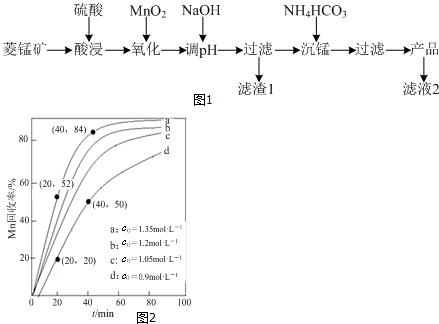
9.稀土是一种不可再生的战略性资源,被广泛应用于电子信息、国防军工等多个领域.一种从废弃阴极射线管(CRT)荧光粉中提取稀土元素钇(Y)的工艺流程如图1:
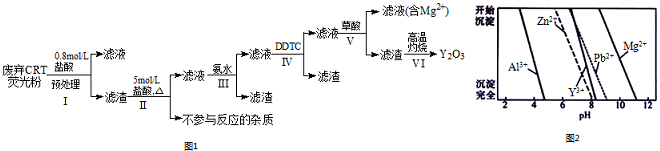
已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如下表所示;
②不同离子沉淀的pH如图2所示.
(1)步骤I中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量等.(答两点)
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-28)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.

已知:①废弃CRT荧光粉的化学组成(某些不参与反应的杂质未列出)如下表所示;
| 阶段/含量%/成分 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
(1)步骤I中进行原料预处理的目的为除去ZnO和Al2O3;富集稀土元素;降低后续耗酸量等.(答两点)
(2)步骤Ⅱ中有黄绿色气体产生,该反应的化学方程式为PbO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O.
(3)步骤Ⅲ中发生的主要反应的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)步骤Ⅳ中除杂试剂DDTC除去的杂质离子有Zn2+、Pb2+,其不能通过直接加碱的方法除去,原因为Zn2+、Pb2+与Y3+沉淀的pH相近,三者因同时沉淀而无法分离.
(5)步骤V中Y3+沉淀完全时,需保证滴加草酸后的溶液中c(C2O42-)不低于2.0×10-6mol/L.
(已知:当离子浓度小于10-5mol/L时,沉淀就达完全;Ksp[Y2(C2O4)3]=8.0×10-28)
(6)步骤Ⅵ中草酸钇隔绝空气加热可以得到Y2O3,该反应的化学方程式为Y2(C2O4)3$\frac{\underline{\;\;△\;\;}}{\;}$Y2O3+3CO↑+3CO2↑.
6. \如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
\如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
①Fe
②HNO3
③Na
④Si.
 \如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
\如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )①Fe
②HNO3
③Na
④Si.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
3.某羧酸和醇反应生成的酯的相对分子质量为104,则该反应的反应物可能是( )
| A. |  和C2H5OH 和C2H5OH | B. | 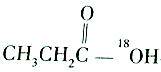 和C2H518OH 和C2H518OH | ||
| C. | 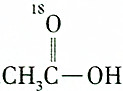 和CH3CH2CH218OH 和CH3CH2CH218OH | D. | 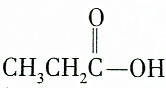 和C2H5OH 和C2H5OH |
10.酯化反应与水解反应均需要使用催化剂,下列有关说法正确的是( )
| A. | 酯化与水解反应均要用浓硫酸作催化剂 | |
| B. | 酯化与水解反应均可用Na0H作催化 | |
| C. | 酯类物质可用Na0H作催化剂,不宜用浓硫酸作催化剂 | |
| D. | 酯化反应使用浓硫酸作催化剂有利于反应向左进行 |
7.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | NO、O2、H2 | D. | SO2、CO2、O2 |
17.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
请回答:
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号),③、④、⑤、⑥、⑦、⑧六种元素对应离子半径最小的为Al3+(填离子符号)
(3)按要求写出下列两种物质的电子式:⑨的最高价氧化物的对应的水化物 ;由H和①形成的原子数之比为1:1的物质
;由H和①形成的原子数之比为1:1的物质 .
.
(4)①的氢化物在常温下与⑨发生反应的化学方程式为2K+2H2O═2KOH+H2↑,所得溶液与⑤的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ |
(1)以上元素中,最高价氧化物对应水化物酸性最强的是HClO4;碱性最强的是KOH;显两性的是Al(OH)3(填化学式)
(2)③、④、⑨三种元素按原子半径由大到小的顺序依次为K>Na>Mg(填元素符号),③、④、⑤、⑥、⑦、⑧六种元素对应离子半径最小的为Al3+(填离子符号)
(3)按要求写出下列两种物质的电子式:⑨的最高价氧化物的对应的水化物
 ;由H和①形成的原子数之比为1:1的物质
;由H和①形成的原子数之比为1:1的物质 .
.(4)①的氢化物在常温下与⑨发生反应的化学方程式为2K+2H2O═2KOH+H2↑,所得溶液与⑤的最高价氧化物对应水化物反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.