题目内容
15.下列反应过程中断键和成键能量变化符合下图所示的是( )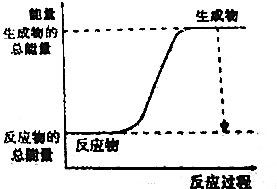
| A. | H2+Cl2$\frac{\underline{\;光照\;}}{\;}$2HCl | B. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |
分析 生成物具有的总能量高于反应物具有的总能量,该反应为吸热反应.
①放热反应:有热量放出的化学反应,因为反应物具有的总能量高于生成物具有的总能量.常见放热反应:燃烧与缓慢氧化,中和反应;金属与酸反应制取氢气,生石灰和水反应,铝热反应等.
②吸热反应:有热量吸收的化学反应,因为反应物具有的总能量低于生成物具有的总能量.常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解等.
解答 解:A.氯气和氢气发生的化合反应是放热反应,故A错误;
B.氢气还原氧化铜的反应是吸热反应,故B正确;
C.CH4在O2中燃烧反应是放热反应,故C错误;
D.铝热反应是放热反应,故D错误.
故选B.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,题目难度中等.

练习册系列答案
相关题目
6. \如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
\如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
①Fe
②HNO3
③Na
④Si.
 \如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )
\如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是( )①Fe
②HNO3
③Na
④Si.
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
3.某羧酸和醇反应生成的酯的相对分子质量为104,则该反应的反应物可能是( )
| A. |  和C2H5OH 和C2H5OH | B. | 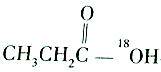 和C2H518OH 和C2H518OH | ||
| C. | 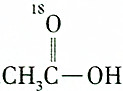 和CH3CH2CH218OH 和CH3CH2CH218OH | D. | 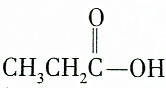 和C2H5OH 和C2H5OH |
10.酯化反应与水解反应均需要使用催化剂,下列有关说法正确的是( )
| A. | 酯化与水解反应均要用浓硫酸作催化剂 | |
| B. | 酯化与水解反应均可用Na0H作催化 | |
| C. | 酯类物质可用Na0H作催化剂,不宜用浓硫酸作催化剂 | |
| D. | 酯化反应使用浓硫酸作催化剂有利于反应向左进行 |
20.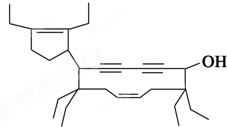 有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol
有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol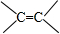 )( )
)( )
 有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol
有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol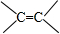 )( )
)( )| A. | 牛式二烯炔醇在水中的溶解度比乙醇小 | |
| B. | 牛式二烯炔醇分子能被催化氧化 | |
| C. | 1mol牛式二烯炔醇最多可与6molH2发生加成反应 | |
| D. | 牛式二烯炔醇的分子式为C29H43O |
7.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | NO、O2、H2 | D. | SO2、CO2、O2 |
14.下列实验操作说法正确的是( )
| 选项 | 实验操作 | 现象与结论(或装置用途) |
| A | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 | 试纸变蓝,说明NH3是碱 |
| B | 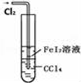 | 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
| C | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
| D | 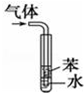 | 用于吸收HCl气体能防倒吸 |
| A. | A | B. | B | C. | C | D. | D |
 C、Be、Cl、Fe等元素及其化合物有重要的应用.
C、Be、Cl、Fe等元素及其化合物有重要的应用.