题目内容
1.关于锌银-稀盐酸原电池的叙述,错误的是( )| A. | 氢离子在银表面被还原,产生气泡 | B. | 银片质量逐渐增大 | ||
| C. | 电子从锌片经导线流向银片 | D. | 锌是负极,其质量逐渐减小 |
分析 锌银-稀盐酸构成的原电池中,锌易失电子发生氧化反应而作负极,银作正极,电子从负极沿导线流向正极,电流流向与电子流向正好相反,正极上氢离子得电子发生还原反应.
解答 解:A.锌作负极、银作正极,正极上氢离子得电子生成氢气,所以氢离子在银表面被还原而产生气泡,故A正确;
B.锌作负极、银作正极,正极上氢离子得电子生成氢气,银片质量不变,故B错误;
C.锌失电子、银片上氢离子得电子,所以电子从负极锌沿导线流向正极银,故C正确;
D.锌易失电子生成锌离子而逐渐被腐蚀,所以其质量逐渐减小,故D正确;
故选B.
点评 本题考查了原电池原理,根据电极上得失电子确定正负极,再结合电子流向来分析解答,总结原电池正负极的判断方法,灵活运用,题目难度不大.

练习册系列答案
相关题目
3.某羧酸和醇反应生成的酯的相对分子质量为104,则该反应的反应物可能是( )
| A. |  和C2H5OH 和C2H5OH | B. | 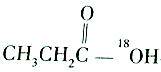 和C2H518OH 和C2H518OH | ||
| C. | 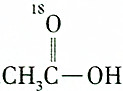 和CH3CH2CH218OH 和CH3CH2CH218OH | D. | 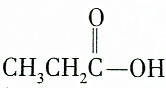 和C2H5OH 和C2H5OH |
20.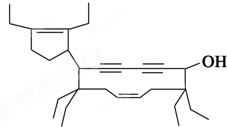 有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol
有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol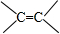 )( )
)( )
 有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol
有一种有机物的键线式酷似牛(如图),故称牛式二烯炔醇.下列有关说法不正确的是(已知1mol-C≡C-与H2反应时相当于2mol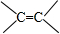 )( )
)( )| A. | 牛式二烯炔醇在水中的溶解度比乙醇小 | |
| B. | 牛式二烯炔醇分子能被催化氧化 | |
| C. | 1mol牛式二烯炔醇最多可与6molH2发生加成反应 | |
| D. | 牛式二烯炔醇的分子式为C29H43O |
7.下列各组气体中,在通常状况下能共存,并且都能用浓硫酸干燥的是( )
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | NO、O2、H2 | D. | SO2、CO2、O2 |
10.下列关于有机化合物的叙述中不正确的是( )
| A. | 甲醛、甲酸、甲酸甲酯和乙醇都能使酸性高锰酸钾溶液褪色 | |
| B. | 相同条件,等物质的量的乙醇、乙二醇、丙三醇中分别加入足量的金属钠产生氢气的体积之比是2:3:6 | |
| C. | 苯酚和乙醛都可以使溴水褪色,但发生的反应类型不同 | |
| D. | 溴水既可鉴别乙烷与乙烯,又可除去乙烷中的乙烯而得到纯净的乙烷 |
11.日本大地震导致的核泄漏使核电站周边大气中放射性核素${\;}_{53}^{131}$I含量偏高,当空气中含量${\;}_{53}^{131}$I超过某种数值时就会对人体产生危害,下面有关说法中正确的是( )
| A. | ${\;}_{53}^{131}$I基态原子的电子运动状态有78种 | |
| B. | 碘盐中含有${\;}_{53}^{131}$I | |
| C. | ${\;}_{53}^{131}$I的中子数与质子数的差是25 | |
| D. | ${\;}_{53}^{131}$I有放射性而${\;}_{53}^{126}$I没有,故它们核外电子排布不同 |

 ;
; ;
;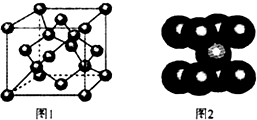 C、Be、Cl、Fe等元素及其化合物有重要的应用.
C、Be、Cl、Fe等元素及其化合物有重要的应用.