题目内容
13.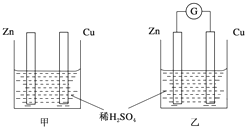 ①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:(1)以下叙述中,正确的是C、D.
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为化学能转化为热能;乙为化学能转化为电能.
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:Cu2++2e-=Cu
②氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池.
(1)如果是碱性燃料电池则负极反应方程式是:H2-2e-+2OH-=2H2O.
(2)如果是酸性燃料电池则负极反应方程式是:H2-2e-=2H+.
分析 ①锌比铜活泼,能与稀硫酸反应,铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲没有形成闭合回路,不能形成原电池,乙形成闭合回路,形成原电池,根据原电池的组成条件和工作原理解答该题;
②(1)碱性燃料电池则负极反应方程式为H2-2e-+2OH-=2H2O;
(2)酸性燃料电池则负极反应方程式H2-2e-=2H+;
解答 解:①(1)A.没有形成闭合回路,不能形成原电池,故A错误;
B.铜为金属活动性顺序表H元素之后的金属,不能与稀硫酸反应,甲烧杯中铜片表面没有气泡产生,故B错误;
C.两烧杯中硫酸都参加反应,氢离子浓度减小,溶液的pH均增大,故C正确;
D.乙能形成原电池反应,较一般化学反应速率更大,所以产生气泡的速率甲中比乙中慢,故D正确;
E.原电池电子由负极经外电路流向正极,乙形成原电池,Zn为负极,Cu为正极,则电流方向Cu→Zn,故E错误;
故答案为:C、D;
(2)甲没有形成闭合回路,不能形成原电池,反应放热,将化学能转变为热能,乙形成闭合回路,形成原电池,将化学能转变为电能;
故答案为:化学能转化为热能;化学能转化为电能;
(3)在乙实验中,如果把硫酸换成硫酸铜溶液,Cu2+在正极上得电子被还原产生Cu,电极反应式为Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
②(1)碱性燃料电池中,氢气在负极上失去电子发生氧化反应,但氢氧根离子会参与负极反应,电极方程式为H2-2e-+2OH-=2H2O,
故答案为:H2-2e-+2OH-=2H2O;
(2)酸性燃料电池,氢气在负极上失去电子发生氧化反应,生成氢离子,负极反应方程式H2-2e-=2H+,
故答案为:H2-2e-=2H+.
点评 本题考查原电池的组成以及工作原理,题目难度不大,注意电极反应式的书写,注意燃料电池中电解质溶液的影响,为易错点.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 用溴水鉴别甲苯、己烷、己烯 | |
| B. | 将稀硫酸、稀硝酸和苯混合加热制硝基苯 | |
| C. | 苯和硝基苯混合物采用分液的方法分离 | |
| D. | 用CuSO4溶液除去由电石和水反应生成的乙炔气体中的杂质 |
| A. |  配制一定物质的量浓度溶液 | |
| B. |  蒸干氯化锰溶液制MnCl2•4H2O | |
| C. |  验证牺牲阳极的阴极保护,在a烧杯中滴入K3[Fe(CN)6]溶液,无蓝色沉淀产生 | |
| D. |  萃取时振荡溶液 |
| A. | S2、S4 | B. | 碘晶体、碘蒸气 | ||
| C. | H、D | D. | ${\;}_{8}^{16}$O2、${\;}_{8}^{18}$O2 |
| A. |  和C2H5OH 和C2H5OH | B. | 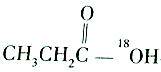 和C2H518OH 和C2H518OH | ||
| C. | 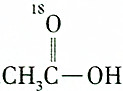 和CH3CH2CH218OH 和CH3CH2CH218OH | D. | 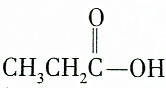 和C2H5OH 和C2H5OH |
 2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.
2011年初,我国“歼20”的试飞引起了世界各国的关注,为减轻飞机的重量,飞机常采用密度较小的镁铝合金作为飞机主体.工厂检测员常通过检测合金中各元素的含量确定合金是否合格.某研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计了下列两种不同实验方案进行探究.填写下列空白.

 ;
; ;
;