题目内容
如图甲是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.
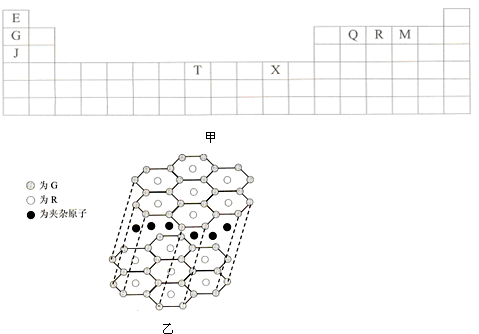
(1)T3+的核外电子排布式是: .X价电子的电子排布式 .
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示).Q、R最高价氧化物对应水化物酸性大小顺序 (用化学式表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)G与R单质直接化合生成一种离子化合物G3R.该晶体具有类似石墨的层状结构(如图乙)每层中,G原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是 .

(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是
(3)下列有关上述元素的说法中,正确的是:
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)G与R单质直接化合生成一种离子化合物G3R.该晶体具有类似石墨的层状结构(如图乙)每层中,G原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是
考点:晶胞的计算,元素周期律和元素周期表的综合应用
专题:
分析:根据元素在周期表中的分布,可知E是H,G是Li,J是Na,Q是C,R是N,M是O,T是Fe,X是铜.
(1)T3+的核外电子为23,X为29号元素,位于第IB族;
(2)第一电离能是失去一个电子所需要的能量,原子轨道处于半充满状态更稳定,非金属强的第一电离能大;非金属强的对应最高价氧化物对应水化物酸性强;
(3)①G单质与J单质,熔点与金属键有关;
②J比X活泼,J在溶液中先与水反应;
③将J2M2溶于水,反应生成NaOH和氧气;
④RE3沸点高于QE4,氨气中含氢键;
⑤Q2E4分子结构中含1个双键和4个C-H;
(4)G与R单质直接化合生成一种离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子水为6×
=2,以此来解答.
(1)T3+的核外电子为23,X为29号元素,位于第IB族;
(2)第一电离能是失去一个电子所需要的能量,原子轨道处于半充满状态更稳定,非金属强的第一电离能大;非金属强的对应最高价氧化物对应水化物酸性强;
(3)①G单质与J单质,熔点与金属键有关;
②J比X活泼,J在溶液中先与水反应;
③将J2M2溶于水,反应生成NaOH和氧气;
④RE3沸点高于QE4,氨气中含氢键;
⑤Q2E4分子结构中含1个双键和4个C-H;
(4)G与R单质直接化合生成一种离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子水为6×
| 1 |
| 3 |
解答:
解:根据元素在周期表中的分布,可知E是H,G是Li,J是Na,Q是C,R是N,M是O,T是Fe,X是铜
(1)T为Fe,原子序数为26,T3+的核外电子为23,其电子排布为[Ar]3d5或1s22s22p63s23p63d5;X为29号元素,位于第IB族,价电子的电子排布式为3d104s1,
故答案为:[Ar]3d5或1s22s22p63s23p63d5;3d104s1;
(2)同周期从左向右第一电离能增大,但N原子的2p电子为半满,为稳定结构,所以N原子的第一电离能最大,C原子的最小,所以第一电离能为N>O>C;非金属性C<N,则Q、R最高价氧化物对应水化物酸性大小顺序为H2CO3<HNO3,
故答案为:N>O>C;H2CO3<HNO3;
(3)①G为Li,J为Na,离子半径越小,金属键越强,Li离子半径小,所以熔点高,故①正确;
②J为Na,X为Cu,Na的活泼性强与水反应,所以在溶液中不能置换出Cu,故②错误;
③J2M2为Na2O2,化学反应中化学键断裂,将J2M2溶于水,要破坏离子键和共价键,故③正确;
④R为N,E为H,Q为C,氨气中存在氢键,所以氨气的沸点高,故④错误;
⑤一个C2H4分子中含有4个C-H键,1个C=C键,含有五个σ键和一个π键,故⑤错误;
故答案为:①③⑤;
(4)G与R单质直接化合生成一种离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子为6×
=2,Li3N中离子个数为3:1,所以层与层之间还原子为Li,故答案为:Li.
(1)T为Fe,原子序数为26,T3+的核外电子为23,其电子排布为[Ar]3d5或1s22s22p63s23p63d5;X为29号元素,位于第IB族,价电子的电子排布式为3d104s1,
故答案为:[Ar]3d5或1s22s22p63s23p63d5;3d104s1;
(2)同周期从左向右第一电离能增大,但N原子的2p电子为半满,为稳定结构,所以N原子的第一电离能最大,C原子的最小,所以第一电离能为N>O>C;非金属性C<N,则Q、R最高价氧化物对应水化物酸性大小顺序为H2CO3<HNO3,
故答案为:N>O>C;H2CO3<HNO3;
(3)①G为Li,J为Na,离子半径越小,金属键越强,Li离子半径小,所以熔点高,故①正确;
②J为Na,X为Cu,Na的活泼性强与水反应,所以在溶液中不能置换出Cu,故②错误;
③J2M2为Na2O2,化学反应中化学键断裂,将J2M2溶于水,要破坏离子键和共价键,故③正确;
④R为N,E为H,Q为C,氨气中存在氢键,所以氨气的沸点高,故④错误;
⑤一个C2H4分子中含有4个C-H键,1个C=C键,含有五个σ键和一个π键,故⑤错误;
故答案为:①③⑤;
(4)G与R单质直接化合生成一种离子化合物Li3N,每层中Li原子构成平面六边形,每个六边形的中心有一个N原子,一个六边形实际Li原子为6×
| 1 |
| 3 |
点评:本题考查晶胞计算、原子结构与性质等,把握原子序数及元素、单质、化合物的性质为解答的关键,注意物质的结构是解答本题的难点,(4)为易错点和难点,题目难度较大.

练习册系列答案
相关题目
一定温度下,在固定容积的密闭容器中充入2molA和1molB发生反应2A(g)+B(g)=3C(g),达到平衡后,C的体积分数为C%,在相同条件下,按下列情况充入物质达到平衡时,C的体积分数也为C%的是( )
| A、1molA 2molC |
| B、4mol C |
| C、2molA 3molC |
| D、1molA 1molB |
下面关于Na2CO3和NaHCO3性质的叙述,不正确的是( )
| A、在水中的溶解度:碳酸钠>碳酸氢钠 |
| B、热稳定性:碳酸钠>碳酸氢钠 |
| C、溶液酸碱性:物质的量浓度相同时,Na2CO3溶液pH小于NaHCO3溶液的pH |
| D、等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,消耗HCl的量前者多 |
下列有机物的命名正确的是( )
| A、3,4,4-三甲基己烷 |
| B、2-甲基-4-乙基戊烷 |
| C、2-甲基-3-戊烯 |
| D、2,2-二甲基戊烷 |