题目内容
硫代硫酸钠是一种常见的化工原料.将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3并生成CO2,其制备反应方程式为:
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是 .
(2)用该方法获得的Na2S2O3?5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水).
【提出假设】
假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:
【查阅资料】①SO2+2H2S═3S↓+2H2O
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4═S↓+SO2+Na2SO4+H2O
③CuSO4+H2S═CuS↓(黑色)+H2SO4
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理? (填“合理”或“不合理”)并说明理由:
【设计方案进行实验】
基于晶体中含有Na2CO3杂质,完成下表实验方案、现象及结论(仪器自选).限选实验试剂:3mol?L-1 H2SO4、1mol?L-1 NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
【问题讨论】
(3)已知:2Na2S2O3+I2═2NaI+Na2S4O6.为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol?L-1的碘水进行多次取样滴定,测得Na2S2O3?5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是 .(写一个)
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是
(2)用该方法获得的Na2S2O3?5H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水).
【提出假设】
假设1:晶体中只含Na2CO3杂质
假设2:晶体中只含Na2S杂质
假设3:
【查阅资料】①SO2+2H2S═3S↓+2H2O
②Na2S2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应:Na2S2O3+H2SO4═S↓+SO2+Na2SO4+H2O
③CuSO4+H2S═CuS↓(黑色)+H2SO4
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立.你认为其结论是否合理?
【设计方案进行实验】
基于晶体中含有Na2CO3杂质,完成下表实验方案、现象及结论(仪器自选).限选实验试剂:3mol?L-1 H2SO4、1mol?L-1 NaOH、酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
| 实验方案 | 现象及结论 |
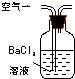
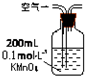
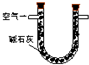
| 取适量晶体于烧瓶中,加入足量3mol?L-1H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有 | 则晶体中含Na2CO3杂质. |
(3)已知:2Na2S2O3+I2═2NaI+Na2S4O6.为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol?L-1的碘水进行多次取样滴定,测得Na2S2O3?5H2O的含量约为102%.若所用试剂及操作均无不当,产生该结果最可能的原因是
考点:探究物质的组成或测量物质的含量,性质实验方案的设计
专题:实验探究和数据处理题,实验设计题
分析:将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3并生成CO2,据此可知反应物为:SO2、Na2S和Na2CO3,生成物为:Na2S2O3和CO2,配平方程式即可;
(1)将蒸馏水加热煮沸一段时间后可以赶走其中溶解的氧气,防止对实验产生干扰;
(2)根据假设1和假设2来提出假设3;
[判断与思考]
硫化氢和二氧化硫之间可以发生反应生成单质硫;碳酸钠可以和硫酸反应生成二氧化碳,硫化钠可以和硫酸反应生成硫化氢,硫化氢可以被高锰酸钾氧化,二氧化碳可以使澄清石灰水变浑浊,据此检验固体成分;
(3)根据实验原理,碘单质的消耗量和Na2S2O3?5H2O的含量是成正比例关系的,根据影响碘单质含量的因素来分析.
(1)将蒸馏水加热煮沸一段时间后可以赶走其中溶解的氧气,防止对实验产生干扰;
(2)根据假设1和假设2来提出假设3;
[判断与思考]
硫化氢和二氧化硫之间可以发生反应生成单质硫;碳酸钠可以和硫酸反应生成二氧化碳,硫化钠可以和硫酸反应生成硫化氢,硫化氢可以被高锰酸钾氧化,二氧化碳可以使澄清石灰水变浑浊,据此检验固体成分;
(3)根据实验原理,碘单质的消耗量和Na2S2O3?5H2O的含量是成正比例关系的,根据影响碘单质含量的因素来分析.
解答:
解:将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3并生成CO2,据此可知反应物为:SO2、Na2S和Na2CO3,生成物为:Na2S2O3和CO2,配平方程式得:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,故答案为;2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;
(1)将蒸馏水加热煮沸一段时间,可以赶走水中的溶解氧(或空气),防止物质被氧气氧化,故答案为:赶走水中的溶解氧(或空气);
(2)根据假设1和假设2,得出假设3是:晶体中含Na2S和Na2CO3两种杂质;
[判断与思考]
如果是Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出,所以推断不合理,碳酸钠可以和硫酸反应生成二氧化碳,硫化钠可以和硫酸反应生成硫化氢,硫化氢可以被高锰酸钾氧化,二氧化碳可以使澄清石灰水变浑浊,如果固体中加入硫酸,产生的气体不会使品红退色,能使澄清石灰水变浑浊在,证明固体只有碳酸钠,
故答案为:晶体中含Na2S和Na2CO3两种杂质;
不合理; Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出;
(3)测得Na2S2O3?5H2O的含量约为102%,即消耗的碘水质量偏高,可能是晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水,故答案为:晶体中含有杂质(如Na2S等)在滴定时参与反应或晶体部分失去结晶水.
(1)将蒸馏水加热煮沸一段时间,可以赶走水中的溶解氧(或空气),防止物质被氧气氧化,故答案为:赶走水中的溶解氧(或空气);
(2)根据假设1和假设2,得出假设3是:晶体中含Na2S和Na2CO3两种杂质;
[判断与思考]
如果是Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出,所以推断不合理,碳酸钠可以和硫酸反应生成二氧化碳,硫化钠可以和硫酸反应生成硫化氢,硫化氢可以被高锰酸钾氧化,二氧化碳可以使澄清石灰水变浑浊,如果固体中加入硫酸,产生的气体不会使品红退色,能使澄清石灰水变浑浊在,证明固体只有碳酸钠,
故答案为:晶体中含Na2S和Na2CO3两种杂质;
不合理; Na2S2O3与稀H2SO4反应生成的SO2和H2S发生反应,可能无H2S逸出;
| 实验方案 | 现象及结论 |
| 取适量晶体于烧瓶中,加入足量3mol?L-1H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有 足量酸性KMnO4溶液、品红溶液、澄清石灰水的洗气瓶. | 若 (高锰酸钾溶液褪色)品红溶液不褪色、 澄清石灰水变浑浊 则晶体中含Na2CO3杂质. |
点评:本题是一道探究物质的组成和含量知识的综合实验题,考查学生分析和解决问题的能力,难度大,综合性强.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列几种试剂不能把等物质的量浓度的Na2CO3,NaHCO3鉴别开的是( )
| A、CaCl2溶液 |
| B、澄清石灰水 |
| C、稀盐酸 |
| D、pH试纸 |
R和Q为短周期中的两种元素,R元素原子的最外层电子数和次外层电子数之差的绝对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定错误的是( )
| A、原子半径:R>Q |
| B、R和Q可形成离子化合物 |
| C、R和Q可形成非极性分子RQ2 |
| D、R和Q可形成共价化合物RQ3 |