题目内容
江苏省有较长的海岸线,海洋资源十分丰富.
(1)从海水中提取镁的主要步骤如下:
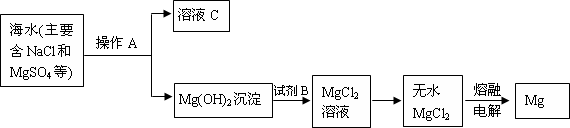
①上述从海水中提取镁的步骤中,需加入某种试剂然后进行操作A,操作A的名称为 ,试剂B选用 (写名称).
②分离出Mg(OH)2后的溶液C中除NaCl外,还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去 离子;加入过量Na2CO3溶液发生反应的离子方程式是 、 .
(2)写出实验室蒸馏海水装置中除温度计外任意两种玻璃仪器的名称 、 .
(1)从海水中提取镁的主要步骤如下:

①上述从海水中提取镁的步骤中,需加入某种试剂然后进行操作A,操作A的名称为
②分离出Mg(OH)2后的溶液C中除NaCl外,还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸.实验中加入过量BaCl2溶液是为了除去
(2)写出实验室蒸馏海水装置中除温度计外任意两种玻璃仪器的名称
考点:物质分离和提纯的方法和基本操作综合应用,海水资源及其综合利用,金属冶炼的一般原理
专题:几种重要的金属及其化合物
分析:从海水中提取镁,应先在海水中加入足量的石灰乳,生成氢氧化镁沉淀,经过滤后氢氧化镁沉淀,滤液C中主要含有氯化钠,氢氧化镁加入盐酸,生成氯化镁,经浓缩结晶、干燥得到干燥的氯化镁固体,电解熔融的氯化镁可得到镁,以此解答该题.
解答:
解:从海水中提取镁,应先在海水中加入足量的石灰乳,生成氢氧化镁沉淀,经过滤后氢氧化镁沉淀,滤液C中主要含有氯化钠,氢氧化镁加入盐酸,生成氯化镁,经浓缩结晶、干燥得到干燥的氯化镁固体,电解熔融的氯化镁可得到镁,
(1)①有以上分析可知操作A为过滤,生成沉淀氢氧化镁沉淀加入盐酸可生成氯化镁,故答案为:过滤;稀盐酸;
②加入过量BaCl2溶液,与硫酸钠反应生成沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,可除去SO42-,加入过量Na2CO3溶液发生反应Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓,以除去过量的钡离子和钙离子,
故答案为:Ba2++SO42-=BaSO4↓;Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
(2)实验室蒸馏海水,需要温度计、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,故答案为:蒸馏烧瓶;冷凝管.
(1)①有以上分析可知操作A为过滤,生成沉淀氢氧化镁沉淀加入盐酸可生成氯化镁,故答案为:过滤;稀盐酸;
②加入过量BaCl2溶液,与硫酸钠反应生成沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,可除去SO42-,加入过量Na2CO3溶液发生反应Ba2++CO32-=BaCO3↓,Ca2++CO32-=CaCO3↓,以除去过量的钡离子和钙离子,
故答案为:Ba2++SO42-=BaSO4↓;Ba2++CO32-=BaCO3↓;Ca2++CO32-=CaCO3↓;
(2)实验室蒸馏海水,需要温度计、蒸馏烧瓶、冷凝管、牛角管、锥形瓶等,故答案为:蒸馏烧瓶;冷凝管.
点评:本题主要考查海水中提取镁的原理,为高频考点,侧重于学生的分析能力和实验能力的考查,解答时应该充分理解物质之间相互作用反应的情况,难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
利用CCl4将碘水中的碘萃取出来,其原理是碘在 中溶解性比在 中的大,可将碘从水中萃取出来.现用10CCl4和15mL碘水在 中混合,充分震荡,精致分层,下层显 色,打开活塞分液,烧杯中接受到的是 .
人体内缺乏会得大脖子病( )
| A、氟 | B、氯 | C、硫 | D、碘 |
用铁片与50mL 1mol/L的硫酸反应制取H2时,下列措施不能使氢气生成速率加大是( )
| A、对该反应体系加热 |
| B、滴加几滴浓硫酸 |
| C、加入少量氯化钠溶液 |
| D、不用铁片,改用铁粉 |