题目内容
9.若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )| A. | 1:2 | B. | 1:4 | C. | 2:1 | D. | 4:1 |
分析 先根据氧化还原反应中得失电子相等配平方程式,再根据化合价变化的和化合价不变的氮原子判断.
解答 解:该反应中,NH4+→N2氮元素的化合价由-3价→0价,生成一个氮气分子需要铵根离子失去6个电子,生成一个二氧化硫分子需要硫酸根离子得到2个电子,所以其最小公倍数是6,然后其它元素根据原子守恒进行配平方程式,所以该方程式为3(NH4)2SO4$\frac{\underline{\;强热\;}}{\;}$3SO2↑+N2↑+4NH3↑+6H2O,该方程式中铵根离子和氨气分子中氮原子的化合价都是-3价,化合价不变,所以该反应中化合价发生变化和未发生变化的N原子数之比为1×2:4×1=1:2,
故选A.
点评 本题考查了氧化还原反应、根据方程式进行有关计算,难度不大,注意该方程式中氧化剂和还原剂是同一种物质,但氧化产物和还原产物不同,所以从生成物进行配平较简便.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
19.现有下列十种物质:
①H2; ②Al2O3; ③CH4; ④CO2; ⑤H2SO4; ⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀硝酸;⑩FeCl3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(1)
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)⑦和⑩的溶液可以用丁达尔现象加以鉴别.
①H2; ②Al2O3; ③CH4; ④CO2; ⑤H2SO4; ⑥Ba(OH)2;⑦红褐色的氢氧化铁液体;⑧氨水;⑨稀硝酸;⑩FeCl3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
(1)
| 分类标准 | 酸性氧化物 | 非电解质 | |
| 属于该类的物质 | ⑦ |
(3)⑦和⑩的溶液可以用丁达尔现象加以鉴别.
20.与钢相比,生铁的含碳量( )
| A. | 较多 | B. | 较少 | C. | 一样多 | D. | 不能确定 |
17.有一包白色粉末,可能含有CuSO4 、NaCl、CaCl2、K2SO4、Na2CO3中的一种或几种,按下列步骤进行实验:
①取少量白色粉末放入试管里,加入适量蒸馏水,振荡得到无色溶液.
②在上述溶液中加入足量氯化钡溶液有白色沉淀生成,再加足量硝酸,沉淀部分消失.
③取上层清液,滴加硝酸银溶液,有白色沉淀生成,再加硝酸,沉淀不消失.
根据实验现象无法确定白色粉末中是否存在的物质是( )
①取少量白色粉末放入试管里,加入适量蒸馏水,振荡得到无色溶液.
②在上述溶液中加入足量氯化钡溶液有白色沉淀生成,再加足量硝酸,沉淀部分消失.
③取上层清液,滴加硝酸银溶液,有白色沉淀生成,再加硝酸,沉淀不消失.
根据实验现象无法确定白色粉末中是否存在的物质是( )
| A. | CuSO4 | B. | NaCl | C. | CaCl2 | D. | 无 |
4.下列对化学知识概括合理的是( )
| A. | 酸性氧化物都是非金属氧化物 | |
| B. | 乙醇和二甲醚分子式相同,结构不同,互为同素异形体 | |
| C. | 丁达尔效应可用于区别溶液与胶体 | |
| D. | 熔融状态能导电的物质一定是离子化合物 |
4.在体积不变的绝热密闭容器中,一定量SO2与1molO2在催化剂作用下发生反应:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H=-QkJ/mol(Q>0).当气体的物质的量减少0.5mol时反应达到平衡.下列叙述正确的是( )
| A. | 再通入1molO2,平衡正向移动,平衡常数不变 | |
| B. | 降低温度,正反应速率先减小后增大 | |
| C. | 平衡时SO2气体的转化率为50% | |
| D. | 该条件下反应放出0.5QkJ的热量 |
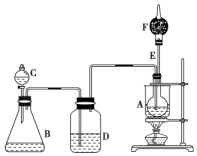 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.