题目内容
14.请回答:(1)用氧化物的形式表示翡翠[NaAl(SiO3)2]的组成Na2O•Al2O3•4SiO2.
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(3)在NaHSO4溶液中滴加Ba(OH2)溶液至溶液呈中性,该反应的离子方程式Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓.
(4)写出下列反应的化学方程式:
①煅烧黄铁矿(FeS2)4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
②已知:氧化性Cl2>Br2>Fe3+,写出FeBr2溶液与等物质的量Cl2反应的离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-.
分析 (1)用氧化物表示物质的组成时,要按照:活泼金属氧化物•不活泼金属氧化物•SiO2•H2O的顺序来书写;
(2)镁能在二氧化碳中燃烧;
(3)在NaHSO4溶液中滴加Ba(OH2)溶液至溶液呈中性,反应生成硫酸钡、硫酸钠和水;
(4)①煅烧黄铁矿生成氧化铁和二氧化硫;
②亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先反应.
解答 解:(1)用氧化物表示物质的组成时,要按照:活泼金属氧化物•不活泼金属氧化物•SiO2•H2O的顺序,故NaAl(SiO3)2的组成可以表示为:Na2O•Al2O3•4SiO2,
故答案为:Na2O•Al2O3•4SiO2;
(2)镁能在二氧化碳中燃烧,化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(3)在NaHSO4溶液中滴加Ba(OH2)溶液至溶液呈中性,反应生成硫酸钡、硫酸钠和水,离子方程式:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓;
故答案为:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓;
(4)①煅烧黄铁矿生成氧化铁和二氧化硫,化学方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;
②向FeBr2中通入等量Cl2,亚铁离子优先反应,然后部分溴离子被氯气氧化,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-,
故答案为:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-.
点评 本题考查了化学方程式的书写、离子方程式书写,题目难度不大,明确发生反应的实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

 53随堂测系列答案
53随堂测系列答案| A. | Cu丝 | B. | 熔融的MgCl2 | C. | 固体NaCl | D. | 蔗糖 |
| A. | Mg | B. | Na | C. | S | D. | Cl |
| A. |  | B. |  | C. |  | D. |  |
| A. | 1:2 | B. | 1:4 | C. | 2:1 | D. | 4:1 |
| A. | 制备氯气时严格检查装置的气密性,并设置尾气吸收装置 | |
| B. | 稀释浓硫酸时,将水倒入浓硫酸中,使用玻璃棒不断搅拌 | |
| C. | 在敞口容器中进行铜与浓硝酸的反应,并观察生成的气体 | |
| D. | 向一支试管中加入少量水,向其中投入一块黄豆大小的钠 |
| A. | 苯 | B. | 乙醇 | C. | 氯仿 | D. | 正戊烷 |

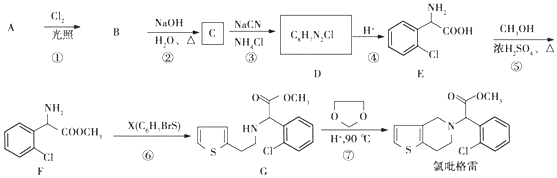
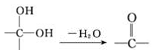 ;②
;②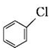 中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$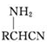
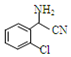 ;C分子中最多有14个原子共平面.
;C分子中最多有14个原子共平面.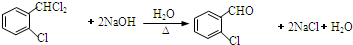 .
. ,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.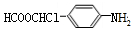 .
.