题目内容
17.有一包白色粉末,可能含有CuSO4 、NaCl、CaCl2、K2SO4、Na2CO3中的一种或几种,按下列步骤进行实验:①取少量白色粉末放入试管里,加入适量蒸馏水,振荡得到无色溶液.
②在上述溶液中加入足量氯化钡溶液有白色沉淀生成,再加足量硝酸,沉淀部分消失.
③取上层清液,滴加硝酸银溶液,有白色沉淀生成,再加硝酸,沉淀不消失.
根据实验现象无法确定白色粉末中是否存在的物质是( )
| A. | CuSO4 | B. | NaCl | C. | CaCl2 | D. | 无 |
分析 ①取少量白色粉末放入试管里,加入适量蒸馏水,振荡得到无色溶液,因硫酸铜溶液为蓝色,则一定不含CuSO4,且CaCl2与K2SO4、Na2CO3不能同时存在;
②在上述溶液中加入足量氯化钡溶液有白色沉淀生成,再加足量硝酸,沉淀部分消失,可知白色沉淀为硫酸钡、碳酸钡,则原混合物一定含K2SO4、Na2CO3;
③取上层清液,滴加硝酸银溶液,有白色沉淀生成,再加硝酸,沉淀不消失,白色沉淀为AgCl,但②中加氯化钡引入氯离子,以此来解答.
解答 解:由①可知一定不含CuSO4,
由②可知一定含K2SO4、Na2CO3,则不含CaCl2,
由③中白色沉淀为AgCl,但②中加氯化钡引入氯离子,则不能确定是否含NaCl,
故选B.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,②中引入氯离子为解答的易错点,题目难度不大.

练习册系列答案
相关题目
7.室温时,0.1mol/L某一元酸HA的水溶液PH=4.下列描述不正确的是( )
| A. | 该溶液中HA有0.1%发生了电离 | |
| B. | 此酸电离平衡常数约为10-7 | |
| C. | 升高温度后溶液的PH增大 | |
| D. | 若将PH=2的HA溶液与PH=12的NaOH溶液等体积混合后PH=7 |
8.下列实验操作、现象或结论正确的是( )
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 往溶液中加入盐酸,若放出能使澄清石灰水变浑浊的无色无味气体,则原溶液中只含CO32- | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
5.下列元素原子半径最小的是( )
| A. | Mg | B. | Na | C. | S | D. | Cl |
12.鉴别下列各组物质,只能采用焰色反应的是( )
| A. | K2CO3 和NaCl | B. | KCl和NaNO3 | C. | NaCl 和MgCl2 | D. | NaCl 和KCl |
2.下列仪器适合用于萃取分液的是( )
| A. |  | B. |  | C. |  | D. |  |
9.若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
| A. | 1:2 | B. | 1:4 | C. | 2:1 | D. | 4:1 |
12. 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: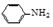 +CH3COOH?
+CH3COOH?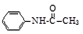 +H2O
+H2O
实验参数:
实验装置:(见图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:用移液管在圆底烧瓶中加入无水苯胺13.95mL,冰醋酸27.60mL,锌粉0.15g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热.
步聚2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.
步聚3:将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼.产品放在干净的表面皿中晾干,称重,计算产率.
请回答下列问题:
(1)步骤1中所选圆底烧瓶的最佳规格为A.
A.50mL B.100mL C.150mL
实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(2)为何要控制分馏柱上端的温度在105?C左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)为了受热均匀,便于控制温度,步聚1加热可采用油浴加热,步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是用玻璃棒摩擦容器内壁(或投入晶种或用冰水冷却).
(4)洗涤乙酰苯胺粗品最合适的试剂是C.
A. 先用冷水洗,再用热水洗 B. 用少量热水洗 C. 用少量冷水洗 D. 用酒精洗
(5)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(6)该实验最终得到纯品13.5克,则乙酰苯胺的产率是66.7%.(结果保留一位小数)
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: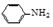 +CH3COOH?
+CH3COOH?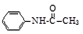 +H2O
+H2O实验参数:
| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体,具有还原性 | 1.00 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:用移液管在圆底烧瓶中加入无水苯胺13.95mL,冰醋酸27.60mL,锌粉0.15g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热.
步聚2:在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品.
步聚3:将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼.产品放在干净的表面皿中晾干,称重,计算产率.
请回答下列问题:
(1)步骤1中所选圆底烧瓶的最佳规格为A.
A.50mL B.100mL C.150mL
实验中加入锌粉的目的是防止苯胺在反应过程中被氧化.
(2)为何要控制分馏柱上端的温度在105?C左右不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率.
(3)为了受热均匀,便于控制温度,步聚1加热可采用油浴加热,步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是用玻璃棒摩擦容器内壁(或投入晶种或用冰水冷却).
(4)洗涤乙酰苯胺粗品最合适的试剂是C.
A. 先用冷水洗,再用热水洗 B. 用少量热水洗 C. 用少量冷水洗 D. 用酒精洗
(5)步骤2得到的粗品中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗品用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤,再将滤液冷却结晶.
(6)该实验最终得到纯品13.5克,则乙酰苯胺的产率是66.7%.(结果保留一位小数)
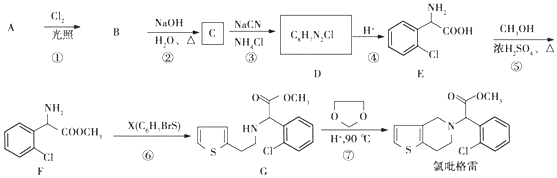
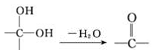 ;②
;②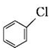 中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子较难水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$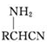
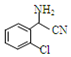 ;C分子中最多有14个原子共平面.
;C分子中最多有14个原子共平面.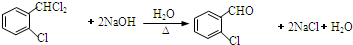 .
.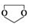 ,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物
,需要经历的反应类型有②①③④③(填写编号).①加成反应 ②消去反应 ③取代反应 ④氧化反应 ⑤还原反应,写出制备化合物 的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反应HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.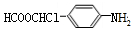 .
.