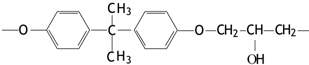
题目内容
3.某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程脱除燃煤尾气中的SO2,同时制得电池材料MnO2(反应条件已省略).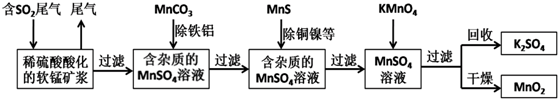
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗;其中玻璃棒的作用是引流,防止液体溅出.
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀.
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀(此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度.是6.0×10-26mol/L.
(4)工业上采用惰性电极电解K2MnO4水溶液的方法来生产KMnO4,请写出阳极的电极反应式MnO42--e-═MnO4-,电解总反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH.
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是bc.(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过bca制得硫酸锰晶体.(MnSO4•H2O,相对分子质量为169)
a.过滤 b.蒸发浓缩 c.冷却结晶 d.灼烧
(7)已知废气中SO2浓度为8.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3燃煤尾气,可得到硫酸锰晶体质量为20.0kg(结果保留3位有效数字).
分析 由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,玻璃棒起引流作用;
(2)从消耗溶液中的酸,促进Al3+和Fe3+水解角度分析;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$,结合Ksp(CuS)计算溶液中Cu2+的浓度;
(4)惰性电极作阳极,则阳极上失去电子发生氧化反应,MnO42-被氧化成MnO4-,阴极上水中的氢得电子生成氢气,据此书写电解的总反应;
(5)准确测定一定体积燃煤尾气中SO2含量,利用其还原性及明显的反应现象分析;
(6)从溶液中获得带结晶水的晶体,一般要经过蒸发浓缩、冷却结晶、过滤等;
(7)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰;结合硫原子守恒可知,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量.
解答 解:由流程可知,二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)过滤需要漏斗、烧杯、玻璃棒等,过滤中玻璃棒的作用为引流,防止液体溅出,
故答案为:烧杯、漏斗;引流,防止液体溅出;
(2)由于碳酸锰能消耗溶液中的酸,降低溶液的酸性,从而促进Al3+和Fe3+水解生成氢氧化物沉淀,
故答案为:消耗溶液中的酸,促进Al3+和Fe3+水解生成氢氧化物沉淀;
(3)当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),c(S2-)=$\frac{Ksp(NiS)}{c(Ni{\;}^{2+})}$=$\frac{1.4×10{\;}^{-24}}{1×10{\;}^{-5}}$=1.4×10-19,由Ksp(CuS)可知溶液中Cu2+的浓度为$\frac{8.4×10{\;}^{-45}}{1.4×10{\;}^{-19}}$=6.0×10-26mol/L,
故答案为:6.0×10-26;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应,则阳极反应为MnO42--e-═MnO4-,阴极上水中的氢得电子生成氢气,所以电解的总反应为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH,
故答案为:MnO42--e-═MnO4-;2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
(5)准确测定一定体积燃煤尾气中SO2含量,二氧化硫与氨水、NaOH反应不易控制,且加指示剂现象观察的滴定终点与反应终点误差大,而b、c中利用还原性及高锰酸钾褪色、淀粉变蓝等可准确测定气体的含量,
故选bc;
(6)从溶液中获得带结晶水的晶体,一般要经过蒸发浓缩、冷却结晶、过滤等,故选bca;
(7)SO2与稀硫酸酸化的软锰矿发生氧化还原反应生成硫酸锰,反应方程式为SO2+MnO2=MnSO4,由硫原子守恒,被吸收的SO2的物质的量等于硫酸锰晶体的物质的量,则硫酸锰晶体的质量为$\frac{1000m{\;}^{3}×8.4g/m{\;}^{3}×90%}{64g/mol}$×169g/mol≈20.0kg,
故答案为:20.0.
点评 本题以物质的制备实验考查混合物分离提纯的综合应用,为高频考点,涉及氧化还原反应、盐类水解、溶度积计算、原子守恒计算等,把握流程分析及混合物分离方法、发生的反应为解答的关键,侧重分析与实验、计算能力的考查,综合性较强,题目难度中等.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | 标准状况下,11.2L的乙烷所含的分子数为0.5NA | |
| B. | 0.5mol C3H8分子中含C-H共价键4NA | |
| C. | 11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1×10-12.如图是向10mLAgNO3溶液中逐滴加入0.1mol•L-1NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中x点的坐标为(10,6) | |
| C. | 图中x点表示溶液中c(Ag+)=c(Cl-) | |
| D. | 把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
| A. | X、Y、Z、W、M、N的原子半径的大小关系为:N>M>W>Y>Z>X | |
| B. | X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物 | |
| C. | 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键 | |
| D. | 由X、W、M、N四种元素形成的化合物的溶于水,水溶液一定呈酸性 |
| A. | 羟基的电子式: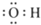 | B. | 醛基的结构简式-COH | ||
| C. | 乙烯分子的最简式:CH2 | D. | 1,2-二溴乙烷的结构简式:C2H4Br2 |
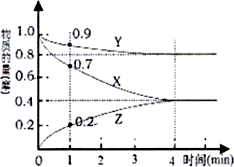 (1)某温度时,在2L的密闭容器在X、Y、Z三种物质的量随时间的变化如图所示.
(1)某温度时,在2L的密闭容器在X、Y、Z三种物质的量随时间的变化如图所示. ,第一电离能:镁大于(填“大于”或“小于”)铝.
,第一电离能:镁大于(填“大于”或“小于”)铝.