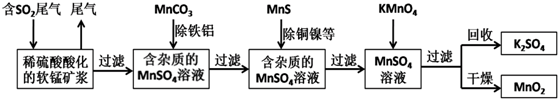
题目内容
11.NA为阿伏加德罗常数的值,下列说法不正确的是( )| A. | 标准状况下,11.2L的乙烷所含的分子数为0.5NA | |
| B. | 0.5mol C3H8分子中含C-H共价键4NA | |
| C. | 11.2 L二氯甲烷所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3NA |
分析 A.依据n=$\frac{V}{Vm}$计算解答;
B.1个C3H8分子中含有8个C-H键;
C.标况下二氯甲烷为液体;
D.乙烯、丙烯(C3H6)、丁烯(C4H8)的最简式相同,混合物的最简式为CH2,据此计算.
解答 解:A.标准状况下,11.2L的乙烷物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,所含的分子数为0.5NA,故A正确;
B.0.5mol C3H8分子中含C-H共价键0.5mol×8×NA=4NA,故B正确;
C.标况下二氯甲烷为液体,不能使用气体摩尔体积,故C错误;
D.混合物的最简式为CH2,使用含有的原子数为$\frac{14g}{14g/mol}$×3×NAmol-1=3NA,故D正确;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确二氯甲烷在标况下不是气体是解题关键,题目难度不大.

练习册系列答案
相关题目
1.下列各组物质两种含氧酸中,前者比后者酸性弱的是( )
| A. | H2SO4和H2SO3 | B. | (HO)2RO2和(HO)2RO3 | C. | HNO3和HNO2 | D. | H2SiO3和H4SiO4 |
2.NaCI是一种化工原料,可以制备一系列物质(如图).下列说法正确的是( )
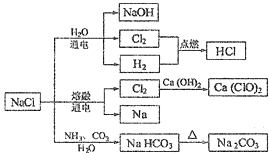

| A. | 常温时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应可用于制备漂白粉,漂白粉的主要成分是Ca(ClO)2和CaCl2 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应都是氧化还原反应 |
19.下列是四种烷烃分子的结构模型图,其中沸点最高的是( )
| A. |  | B. |  | C. |  | D. |  |
6.下列叙述中,正确的是( )
| A. | 氯气中含有的少量氯化氢,可用氢氧化钠溶液除去 | |
| B. | NaHCO3的热稳定性比Na2CO3强 | |
| C. | 过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+ | |
| D. | 氨气喷泉实验说明氨气极易溶解于水 |
16.下列说法正确的是( )
| A. | 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用 | |
| B. | KNO3、KClO3与单质S、C2H5OH混搭存放在同一库房间 | |
| C. | 包装用材料聚乙烯、聚氯乙烯等都属于烃 | |
| D. | 绿色化学的核心就是治理工业生产对环境产生的污染 |
20.海水中蕴藏着丰富的资源,海水综合利用的流程图如图1:
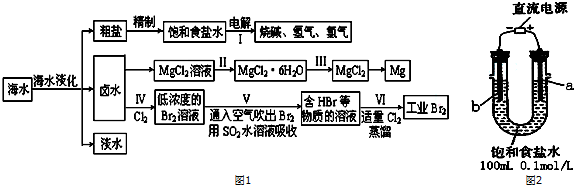
(一)某化学研究小组用图2装置模拟步骤I电解食盐水(用铁和石墨做电极).
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.下表是生成氢氧化物沉淀的pH:
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是b(填序号,下同),加入c调节溶液的pH,充分反应后过滤,可得MgCl2溶液.
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2•H2O获得MgCl2的操作是:将MgCl2•6H2O在干燥的HCl气流中加热.
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.

(一)某化学研究小组用图2装置模拟步骤I电解食盐水(用铁和石墨做电极).
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.下表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2•H2O获得MgCl2的操作是:将MgCl2•6H2O在干燥的HCl气流中加热.
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.
19.人们研究发现金星大气中有一种称之为硫化羰(COS)的分子,其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列有关COS的推测肯定不正确的是( )
| A. | COS分子是含有极性键的极性分子 | |
| B. | COS属于离子化合物 | |
| C. | COS的结构式为S=C=O | |
| D. | COS分子中所有原子都满足8电子稳定结构 |