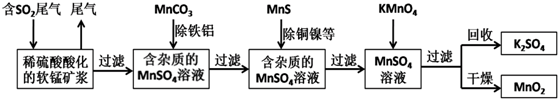
题目内容
13.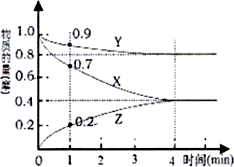 (1)某温度时,在2L的密闭容器在X、Y、Z三种物质的量随时间的变化如图所示.
(1)某温度时,在2L的密闭容器在X、Y、Z三种物质的量随时间的变化如图所示.由图中所给数据进行分析,该反应的化学方程式为3X+Y?2Z,反应开始至1min,X的平均反应速率为0.15mol•L-1•min-1,当反应达到最大限度时,X的转化率为60%,Y的物质的量浓度为
0.4mol•L-1.
(2)可逆反应:2NO2(g)?2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是①④(填序号)
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③混合气体的密度不再改变
④混合气体的颜色不再改变.
分析 (1)由图可知,该反应为可逆反应,反应开始到平衡过程中X、Y、Z的物质的量的变化值,三者之比等于化学计量数之比,从而得到该反应的化学反应方程式;
反应开始至1min,X的平均反应速率通过v(X)=$\frac{△n(X)}{V•△t}$计算;
当反应达到最大限度时,△n(X)=1.0mol-0.4mol=0.6mol,因此X的转化率为$\frac{0.6mol}{1.0mol}$×100%,Y的物质的量为0.8mol,体积为2L,带入c=$\frac{n}{V}$计算浓度;
(2)①生成O2代表V正,生成NO2代表V逆,单位时间内生成nmolO2的同时生成2nmolNO2,说明V正(O2):V逆(NO2)=1:2,说明反应达到平衡状态;
②生成O2和生成NO都代表V正;
③根据ρ=$\frac{m}{V}$分析ρ是否为随时间变化而变化的物理量;
④混合气体的颜色不再改变,说明NO2的浓度不再变化.
解答 解:(1)由图可知,4min后各物质的物质的量不随时间的变化而变化,该反应为可逆反应,X、Y的物质的量随时间的增大而减小,X、Y为反应物,Z为生成物,反应开始到平衡过程中,△n(X)=1.0mol-0.4mol=0.6mol,△n(Y)=1.0mol-0.8mol=0.2mol,△n(Z)=0.4mol-0=0.4mol,△n(X):△n(Y):△n(Z)=0.6mol:0.2mol:0.4mol=3:1:2,因此该反应的化学方程式为3X+Y?2Z,
反应开始至1min,X的平均反应速率通过v(X)=$\frac{△n(X)}{V•△t}$=$\frac{1.0mol-0.7mol}{2L×1min}$=0.15mol•L-1•min-1,
当反应达到最大限度时,△n(X)=1.0mol-0.4mol=0.6mol,因此X的转化率为$\frac{0.6mol}{1.0mol}$×100%=60%,Y的物质的量为0.8mol,体积为2L,Y的物质的量浓度为$\frac{0.8mol}{2L}$=0.4mol•L-1,
故答案为:3X+Y?2Z;0.15;60%;0.4;
(2)①生成O2代表V正,生成NO2代表V逆,单位时间内生成nmolO2的同时生成2nmolNO2,说明V正(O2):V逆(NO2)=1:2,说明反应达到平衡状态;
②生成O2和生成NO都代表V正,不能说明正逆反应速率相等,因此单位时间内生成nmolO2的同时生成2nmolNO,不能确定反应达到化学平衡状态;
③反应体系中全部为气体,因此混合气体的总质量m为定值,容器的体积为2L,因此V是定值,由ρ=$\frac{m}{V}$可知,混合气体的密度是不随时间变化而变化的物理量,因此混合气体的密度不再改变不能说明反应达到化学平衡状态;
④混合气体的颜色不再改变,说明NO2的浓度不再变化,各组分的浓度保持恒定,说明反应达到化学平衡状态;
故答案为:①④.
点评 本题考查化学反应速率和化学平衡,为高频考点,化学方程式的确定和化学平衡状态的判定是该题的难点和易错点,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | H2SO4和H2SO3 | B. | (HO)2RO2和(HO)2RO3 | C. | HNO3和HNO2 | D. | H2SiO3和H4SiO4 |
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列物质本身具有的能量最低的是A(填字母代号).
A.H2 B.Cl2C.Br2 D.I2
(2)下列氢化物中最稳定的是A(填字母代号).
A.HCl B.HBr C.HI
(3)1molCl2与足量的H2完全反应时放出 (填“吸收”或“放出”)热量185kJ.
| A. | 铁 | B. | 蔗糖 | C. | 氯化钠溶液 | D. | 氢氧化铜 |
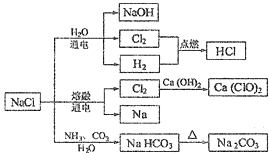
| A. | 常温时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应可用于制备漂白粉,漂白粉的主要成分是Ca(ClO)2和CaCl2 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 图中所示转化反应都是氧化还原反应 |
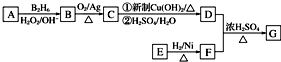
 .
. .
.
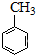 $→_{水溶加热}^{浓H_{2}SO_{4}浓HNO_{3}}$
$→_{水溶加热}^{浓H_{2}SO_{4}浓HNO_{3}}$
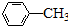 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$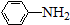 (弱碱性,易被氧化)
(弱碱性,易被氧化) .
.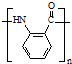 .
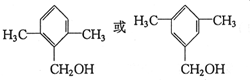
. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构.
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,X有3种结构. →B
→B 等.
等. 、
、 等
等 属于不同类别
属于不同类别