题目内容
9.取100mL 0.3mol/L盐酸和300mL 0.25mol/L硫酸注入500mL容量瓶中,加水稀释到刻度线,该混合物中H+的物质的量浓度是0.36mol/L,pH为0.44.分析 n(HCl)=0.1L×0.3mol/L=0.03mol,n(H2SO4)=0.3L×0.25mol/L=0.075mol,以此计算n(H+),结合c=$\frac{n}{V}$、pH=-lgc(H+)计算.
解答 解:n(HCl)=0.1L×0.3mol/L=0.03mol,n(H2SO4)=0.3L×0.25mol/L=0.075mol,
n(H+)=0.03mol+0.075mol×2=0.18mol,
c(H+)=$\frac{0.18mol}{0.5L}$=0.36mol/L,
pH=0.44.
故答案为:0.36mol/L;0.44.
点评 本题考查了混合液中物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式即可解答,试题侧重基础知识的考查,培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
4.在150℃时使NH4HCO3分解,将所产生的气体依次通过Na2O2和浓H2SO4,则Na2O2增重ag,浓H2SO4增重bg;若将上述气体先通过浓H2SO4,则使酸液增重dg,再通过Na2O2,则使之增重cg.设气体皆完全被吸收,a、b、c、d质量由大到小的排列顺序正确的是( )
| A. | dacb | B. | bcad | C. | acbd | D. | dcba |
14.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤.正确的操作顺序是( )
| A. | ②③①④⑤ | B. | ①②③⑤④ | C. | ③②①⑤④ | D. | ③⑤②①④ |
1.化学与生活密切相关,下列说法正确的是( )
| A. | 用热的烧碱溶液除去瓷器表面污垢 | |
| B. | 铝制餐具不宜长时间存放酸性、碱性或咸的物质 | |
| C. | 漂白粉长期放置空气中会被空气中的氧气氧化而变质 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
18.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在强碱性溶液中:Na+、K+、Al3+、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO42- |
19.X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )
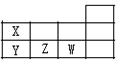

| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |

