题目内容
4.下列叙述中正确的是( )| A. | 原电池的负极发生还原反应 | |
| B. | 电化学反应的实质是金属单质失去电子形成阳离子,而电子直接给氧化剂 | |
| C. | 金属在潮湿环境中主要发生析氢腐蚀 | |
| D. | 铜铁在潮湿的中性环境中锈蚀时,开始有Fe(OH)2,而后逐渐变成Fe(OH)3和Fe2O3 |
分析 A、原电池的负极发生氧化反应;
B、金属的化学腐蚀是金属失电子直接和氧化剂反应的过程;
C、在潮湿的空气中,主要是中性环境,金属的电化学腐蚀主要是吸氧腐蚀;
D、当水膜呈弱酸性或中性时腐蚀吸氧腐蚀.吸氧腐蚀是钢铁腐蚀的主要因素.在钢铁发生吸氧腐蚀时,负极上是铁放电生成Fe2+:Fe-2e-=Fe2+,正极上氧气放电:O2+4e-+2H2O═4OH-,故总反应为:2Fe+O2+2H2O═2Fe(OH)2,被氧化为Fe(OH)2:4Fe(OH)2+O2+2H2O=Fe(OH)3,Fe(OH)3分解即得铁锈:2Fe(OH)3=Fe2O3•nH2O+(3-n)H2O.
解答 解:A、原电池的负极发生氧化反应,而不是还原反应,故A错误;
B、金属的化学腐蚀实质是:M-ne-=Mn+,是金属失电子直接和氧化剂反应的过程,故B正确;
C、在潮湿的空气中,主要是中性环境,金属的电化学腐蚀主要是吸氧腐蚀,而不是吸氢腐蚀,故C错误;
D、在钢铁发生吸氧腐蚀时,负极上是铁放电生成Fe2+:Fe-2e-=Fe2+,正极上氧气放电:O2+4e-+2H2O═4OH-,故总反应为:2Fe+O2+2H2O═2Fe(OH)2,被氧化为Fe(OH)2:4Fe(OH)2+O2+2H2O=Fe(OH)3,Fe(OH)3分解即得铁锈:2Fe(OH)3=Fe2O3•nH2O+(3-n)H2O,故所得铁锈的主要成分为Fe2O3•nH2O,故D错误;
故选B.
点评 本题考查学生金属腐蚀的实质以及金属腐蚀的类型的判断,题目难度不大,注意掌握金属的腐蚀类型,明确金属的化学腐蚀与电化学腐蚀的原理,能够区分析氢腐蚀与吸氧腐蚀的条件.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
14.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤.正确的操作顺序是( )
| A. | ②③①④⑤ | B. | ①②③⑤④ | C. | ③②①⑤④ | D. | ③⑤②①④ |
12.从柑橘中提炼得结构式为 的化合物,则下列有关它的推断错误的是( )
的化合物,则下列有关它的推断错误的是( )
 的化合物,则下列有关它的推断错误的是( )
的化合物,则下列有关它的推断错误的是( )| A. | 分子式为C10H16 | B. | 其一氯代物有9种 | ||
| C. | 常温下呈固态,比水重 | D. | 能与溴水发生加成反应 |
19.X、Y、Z、W 是短周期元素,其在周期表的位置如图,请找出错误选项( )
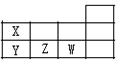

| A. | 原子半径:Y>Z>W | B. | 酸性:HWO4>HXO3>H3YO4 | ||
| C. | 热稳定性:HW>XH3>YH3 | D. | 离子半径:Y3-<Z2-<W- |
16.在下列变化过程中,没有破坏化学键的是( )
| A. | 将食盐加热融化 | B. | 将蔗糖溶于水中 | ||
| C. | 将NO2溶于水中 | D. | 将氢气和氯气混合后光照反应 |


 ,E中含有官能团的名称是羟基、羧基.
,E中含有官能团的名称是羟基、羧基. 或
或 、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
、2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O. 或
或 ,由E导H的反应类型为缩聚反应.
,由E导H的反应类型为缩聚反应.