题目内容
11.下列有关说法正确的是( )| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
分析 A.△H-T△S<0 的反应可自发进行;
B.在Na2S溶液中加入AgCl固体,发生沉淀的转化生成Ag2S沉淀;
C.该反应为放热反应,升高温度,平衡逆向移动;
D.Kw随着温度的升高而增大,可知升高温度,电离平衡正向移动.
解答 解:A.△H-T△S<0 的反应可自发进行,△S>0,则室温下不能自发进行,说明该反应的△H>0,故A错误;
B.在Na2S溶液中加入AgCl固体,发生沉淀的转化生成Ag2S沉淀,则溶液中c(S2-)减小,故B正确;
C.该反应为放热反应,升高温度,平衡逆向移动,则H2的平衡转化率减小,而反应速率增大,故C错误;
D.Kw随着温度的升高而增大,可知升高温度,电离平衡正向移动,则水的电离是吸热反应,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握综合判据的应用、沉淀转化、平衡移动为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
相关题目
13.镁铝组成的混合物平均分成两份,一份与足量氢氧化钠溶液反应,另一份与足量稀盐酸反应,产生氢气的质量前者是后者的二分之一,则混合物中镁铝的质量比是( )
| A. | 1:1 | B. | 3:4 | C. | 4:3 | D. | 3:2 |
19.t℃时,相对分子质量为A的某物质的饱和溶液,其物质的量浓度为Bmol•L-1,密度为ρg•cm-3,则该物质在t℃时溶解度为( )
| A. | $\frac{100AB}{1000ρ-AB}$g | B. | $\frac{AB}{1000ρ-AB}×100%$g | ||
| C. | $\frac{AB}{100ρ}×100$g | D. | $\frac{100AB}{ρ-AB}$g |
6.下列实验操作或原理正确的是( )
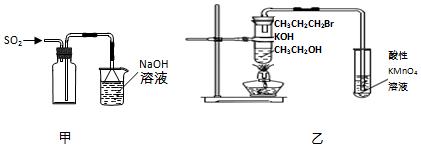

| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
16.下列操作中错误的是( )
| A. | 除去乙酸乙酯中的少量乙酸:加入饱和Na2CO3溶液,分液 | |
| B. | 除去Fe2O3中的少量Al2O3:加入过量NaOH溶液,过滤,洗涤干燥 | |
| C. | 除去氯气中的少量氯化氢:通过盛有饱和食盐水溶液的洗气瓶 | |
| D. | 提取溶解在水中的少量碘:加入酒精,振荡、静置分层后,取出有机层再分离 |
20.用惰性电极电解CuSO4溶液一段时间后,停止电解,向所得溶液中加入0.1molCu2(OH)2CO3,溶液浓度恢复至电解前,关于该电解过程的说法不正确的是( )
| A. | 生成Cu的物质的量是0.2mol | B. | 转移电子的物质的量是0.4mol | ||
| C. | 随着电解的进行溶液的pH减小 | D. | 阳极反应是2H2O-4e-=4H++O2↑ |

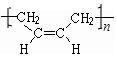 .
.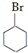 +NaOH$\stackrel{加热}{→}$
+NaOH$\stackrel{加热}{→}$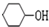 +NaBr.
+NaBr.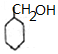 制备的合成路线.
制备的合成路线.