题目内容
6.下列实验操作或原理正确的是( )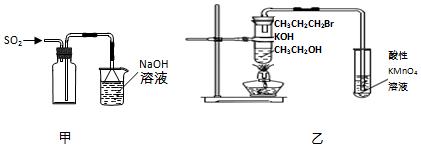
| A. | 用装置甲收集SO2气体 | |
| B. | 用装置乙验证1-溴丙烷发生消去反应是否生成烯烃 | |
| C. | 酸碱中和滴定过程中,眼睛必须注视滴定管刻度的变化 | |
| D. | 配制溶液定容时,俯视容量瓶刻度会使所配溶液的浓度偏高 |
分析 A.二氧化硫的密度大于空气,应该采用向上排空气法收集;
B.乙醇易挥发,挥发出的乙醇能够使酸性高锰酸钾溶液褪色,干扰了检验结果;
C.中和滴定中,眼睛应该注视锥形瓶中溶液颜色变化;
D.俯视定容,加入蒸馏水体积偏小.
解答 解:A.二氧化硫的密度比空气答,收集SO2气体的导管应该采用长进短出的方式,故A错误;
B.制取的丙烯中含有乙醇,乙醇也能够使酸性高锰酸钾溶液褪色,干扰了烯烃的检验,可用溴水检验,故B错误;
C.酸碱中和滴定过程中,眼睛必须注视锥形瓶中溶液颜色变化,以便及时判断滴定终点,不需要观察滴定管刻度的变化,故C错误;
D.配制溶液定容时,俯视容量瓶刻度会使加入蒸馏水体积偏小,所配溶液体积偏小,根据c=$\frac{n}{V}$可知所得溶液的浓度偏高,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度不大,涉及气体制备与收集、烯烃检验、中和滴定、溶液配制等知识,明确常见化学实验基本操作方法即可解答,试题有利于提高学生的化学实验能力.

练习册系列答案
相关题目
8. 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.
下列有关叙述正确的是( )
 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.下列有关叙述正确的是( )
| A. | 电极a的反应式为:CH4+4O2--8e-=CO2+2H2O | |
| B. | 电极b是正极,O2-由电极a流向电极b | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b | |
| D. | 当固体电解质中有2 mol O2-通过时,外电路通过电子8 mol |
17.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 光导纤维导电能力很强,是一种很好的通讯材料 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 氯气泄漏时,应用浸有纯碱溶液的湿毛巾捂住口鼻向高处转移 | |
| D. | 用含有橙色酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
11.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
18.化学反应SO2+NO2=SO3+NO的反应类型是( )
| A. | 化合反应 | B. | 氧化还原反应 | C. | 置换反应 | D. | 复分解反应 |
16.H、C、N、O、Na、Al、S、Cl、Ca是常见的9种元素.
(1)写出由上述9种元素的几种组成的既含有离子键又含共价键的离子化合物的化学式NaOH(或NaClO、Na2O2等);既含极性共价键又含非极性共价键的共价化合物的化学式H2O2(或C2H4、N2H4).
(2)O元素的一种中子数为10的核素的符号表示为818O,N的原子结构示意图 .
.
(3)上述9种元素中的金属工业冶炼方法是A
A.全部采用电解法
B.其中2种采用电解法,另外一种采用热分解法
C.其中一种采用电解法,另外两种采用热还原法
D.全部采用加热分解法
(4)用“大于”“小于”或“等于”填空
(5)甲与乙在溶液中的转化关系如右图所示(反应条件省略)甲不可能是D.
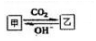
A.NH3 B.AlO2- C.CO32- D.CH3COO-
(6)CaCO3和适量HCl溶液反应,当反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如图所示.
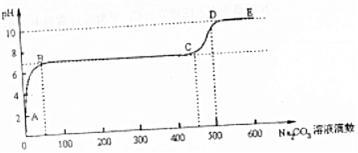
请用离子方程式表示B-C段发生的反应Ca2++CO32-=CaCO3↓;C点到D点pH增大的原因可用离子方程式表示为CO32-+H2O?HCO3-+OH-.
(1)写出由上述9种元素的几种组成的既含有离子键又含共价键的离子化合物的化学式NaOH(或NaClO、Na2O2等);既含极性共价键又含非极性共价键的共价化合物的化学式H2O2(或C2H4、N2H4).
(2)O元素的一种中子数为10的核素的符号表示为818O,N的原子结构示意图
 .
.(3)上述9种元素中的金属工业冶炼方法是A
A.全部采用电解法
B.其中2种采用电解法,另外一种采用热分解法
C.其中一种采用电解法,另外两种采用热还原法
D.全部采用加热分解法
(4)用“大于”“小于”或“等于”填空
| 离子半径 | 还原性 | 得电子能力 |
| N3-大于Al3+ | O2-小于S2- | 35Cl等于37Cl |

A.NH3 B.AlO2- C.CO32- D.CH3COO-
(6)CaCO3和适量HCl溶液反应,当反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得PH变化曲线如图所示.

请用离子方程式表示B-C段发生的反应Ca2++CO32-=CaCO3↓;C点到D点pH增大的原因可用离子方程式表示为CO32-+H2O?HCO3-+OH-.
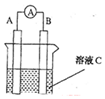 (1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
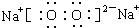 .
.