题目内容
20.用惰性电极电解CuSO4溶液一段时间后,停止电解,向所得溶液中加入0.1molCu2(OH)2CO3,溶液浓度恢复至电解前,关于该电解过程的说法不正确的是( )| A. | 生成Cu的物质的量是0.2mol | B. | 转移电子的物质的量是0.4mol | ||
| C. | 随着电解的进行溶液的pH减小 | D. | 阳极反应是2H2O-4e-=4H++O2↑ |
分析 电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,由此分析解答.
解答 解:电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,
第二阶段:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.1molCu2(OH)2CO3 就相当于加入0.2molCuO和0.1mol水,
A、生成Cu的物质的量是0.2mol,故A正确;
B、第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.2mol,转移电子的物质的量=0.2mol×2=0.4mol;
第二阶段:电解生成0.1mol水转移电子的物质的量=0.1mol×2=0.2mol,
所以解过程中共转移的电子数为0.4mol+0.2mol=0.6mol,故B错误;
C、随着电解的进行硫酸的浓度增大,溶液的pH减小,故C正确;
D、阳极始终是氢氧根离子放电,生成氧气,电极反应式为:2H2O-4e-=4H++O2↑,故D正确;
故选B.
点评 本题考查了电解原理,明确实际上加入的物质是解本题关键,再根据原子守恒、转移电子守恒来分析解答,难度中等.

| X | Y | |
| Z | W |
(1)元素Z位于周期表中的位置第3周期第ⅤA族
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(填写化学式,下同);X、Y、Z三种 元素的最高价氧化对应水化物中酸性由强到弱的依次为HNO3>H3PO4>H2CO3
(3)Y的气态氢化物和其最高价氧化物对应的水化物相互反应的离子方程式为:NH3+H+=NH4+.
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向淀粉NaI溶液中加入氯水 | 溶液变蓝 | 氧化性:C12>I2 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| B. | Na2CO3溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| C. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c[(NH4)2SO4] | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
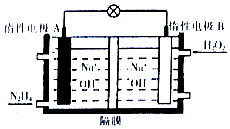 肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
肼(N2H4)是一种高能燃料,在工业生产中用途广泛.