题目内容
19.t℃时,相对分子质量为A的某物质的饱和溶液,其物质的量浓度为Bmol•L-1,密度为ρg•cm-3,则该物质在t℃时溶解度为( )| A. | $\frac{100AB}{1000ρ-AB}$g | B. | $\frac{AB}{1000ρ-AB}×100%$g | ||
| C. | $\frac{AB}{100ρ}×100$g | D. | $\frac{100AB}{ρ-AB}$g |
分析 根据溶质质量分数与物质的量浓度的关系c=$\frac{1000ρw}{M}$计算出该饱和溶液的质量分数,然后根据溶液中溶质的质量分数w%=$\frac{S}{100+S}$计算.
解答 解:设溶质质量分数为w%,溶质溶解度为S,溶质的物质的量浓度C=$\frac{1000ml/L×ρg/c{m}^{3}×w%}{Ag/mol}$=Bmol•L-1;
w%=$\frac{S}{100+S}$×100%;整理计算得出溶解度S=$\frac{100AB}{1000ρ-AB}$g;
故选A.
点评 本题考查了物质的量浓度的计算,题目难度不大,注意掌握物质的量浓度与溶质质量分数的关系,明确物质的量浓度、溶质质量分数的表达式为解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1. 乙烯催化氧化成乙酸可设计成如图所示的燃料电池,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙酸可设计成如图所示的燃料电池,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
 乙烯催化氧化成乙酸可设计成如图所示的燃料电池,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
乙烯催化氧化成乙酸可设计成如图所示的燃料电池,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该装置能量转化形式是电能转化为化学能 | |
| B. | 负极反应式为:CH2═CH2+2e-+H2O═CH3CHO+2H+ | |
| C. | 每有0.1molO2反应,则向正极迁移的H+的物质的量为0.4mol | |
| D. | 电流方向:电极a→负载→电极b |
10.四种短周期元素在周期表中的相对位置如表格所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中的位置第3周期第ⅤA族
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(填写化学式,下同);X、Y、Z三种 元素的最高价氧化对应水化物中酸性由强到弱的依次为HNO3>H3PO4>H2CO3
(3)Y的气态氢化物和其最高价氧化物对应的水化物相互反应的离子方程式为:NH3+H+=NH4+.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中的位置第3周期第ⅤA族
(2)这些元素的氢化物中,水溶液碱性最强的是NH3(填写化学式,下同);X、Y、Z三种 元素的最高价氧化对应水化物中酸性由强到弱的依次为HNO3>H3PO4>H2CO3
(3)Y的气态氢化物和其最高价氧化物对应的水化物相互反应的离子方程式为:NH3+H+=NH4+.
4.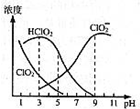 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白,亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | “有效氯含量”可用来衡量含氯消毒剂的消毒能力,指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,则NaClO2的有效氯含量约为1.57 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
11.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
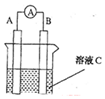 (1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).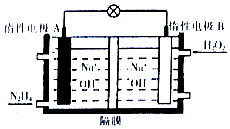 肼(N2H4)是一种高能燃料,在工业生产中用途广泛.
肼(N2H4)是一种高能燃料,在工业生产中用途广泛.