题目内容
X、Y为两种短周期元素,Y的原子半径比X大.下列判断正确的是( )
| A、若X、Y同主族,则形成单质的熔沸点X>Y |
| B、若X、Y同周期,则第一电离能X>Y |
| C、若X、Y同主族,X、Y分别形成气态氢化物的稳定性X>Y |
| D、若X、Y同主族,X、Y分别形成简单离子的半径X<Y |
考点:原子结构与元素的性质
专题:元素周期律与元素周期表专题
分析:A.若X和Y同主族,Y的原子半径比X大,则原子序数Y>X,单质的熔沸点,熔沸点与晶体类型有关;
B.若X、Y同周期,Y的原子半径比X大,则原子序数Y<X,同周期随原子序数增大第一电离能呈增大趋势,但元素原子核外为全满、半满、全空时,能量较低,第一电离能高于同周期相邻元素;
C.元素非金属性越强,其氢化物越稳定;
D.若X为H元素,Y为Li元素,离子半径Li+<H-.
B.若X、Y同周期,Y的原子半径比X大,则原子序数Y<X,同周期随原子序数增大第一电离能呈增大趋势,但元素原子核外为全满、半满、全空时,能量较低,第一电离能高于同周期相邻元素;
C.元素非金属性越强,其氢化物越稳定;
D.若X为H元素,Y为Li元素,离子半径Li+<H-.
解答:
解:A.若X和Y同主族,Y的原子半径比X大,则原子序数Y>X,单质的熔沸点与晶体类型有关,如熔沸点:硫>氧气,Li>氢气,晶体Si<石墨,故A错误;
B.若X、Y同周期,Y的原子半径比X大,则原子序数Y<X,同周期随原子序数增大第一电离能呈增大趋势,但Mg元素、N元素原子核外为全满、半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故B错误;
C.同主族自上而下,元素非金属性非金属性减弱,氢化物稳定性减弱,故C正确;
D.若X为H元素,Y为Li元素,离子半径Li+<H-,故D错误,
故选C.
B.若X、Y同周期,Y的原子半径比X大,则原子序数Y<X,同周期随原子序数增大第一电离能呈增大趋势,但Mg元素、N元素原子核外为全满、半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故B错误;
C.同主族自上而下,元素非金属性非金属性减弱,氢化物稳定性减弱,故C正确;
D.若X为H元素,Y为Li元素,离子半径Li+<H-,故D错误,
故选C.
点评:本题考查原子结构与元素性质,侧重对元素周期律的考查,D选项为易错点,学生容易忽略氢负离子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写正确的是( )
| A、大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、氯化镁溶液中滴入氢氧化钠溶液:MgCl2+2OH-═Mg(OH)2↓+2Cl- |
| D、氯化钡溶液与稀硫酸混合:Ba2++SO42-=BaSO4↓ |
写出实验现象,按要求写离子方程式.
(1)向FeCl2溶液中加氨水,现象为 离子方程式 .
(2)向FeCl2溶液中加氯水,现象为 离子方程式 .
(3)向FeCl3溶液中加KSCN,现象为 离子方程式 .
(1)向FeCl2溶液中加氨水,现象为
(2)向FeCl2溶液中加氯水,现象为
(3)向FeCl3溶液中加KSCN,现象为
足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr混合溶液中,在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)( )
A、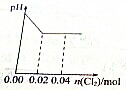 |
B、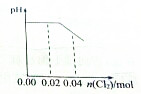 |
C、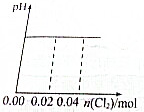 |
D、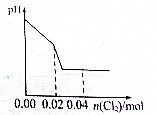 |
常温下,相同物质的量浓度的下列溶液中,pH最小的是( )
| A、KOH |
| B、NH3?H2O |
| C、HCl |
| D、H2SO4 |
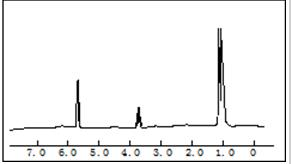 某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题:
某有机物完全燃烧,只生成二氧化碳和水,元素分析结果为C%=62.1%,H%=10.3%,对该物质进行质谱分析,在所得的质谱图中有质荷比分别的27、29、31、44、50、58六条线,右图是该物质的核磁共振氢谱,并且峰面积比分别为1:2:3,根据上述信息,完成下列问题: