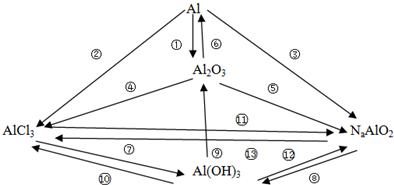
题目内容
A、B、C、D、E、F为六种短周期主族元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的0.75倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成.请回答下列问题:
(1)写出F的元素名称 ,元素B在周期表中的位置 .
(2)判断C、D、E原子半径的大小顺序 ,比较B和E的气态氢化物的稳定性大小 .
(3)写出单质D与C的最高价氧化物的水化物反应的离子方程式 .
(4)由A、B、C、E四种元素共同构成的两种化合物在溶液中相互间可发生化学反应,试写出该反应的离子方程式 .
(1)写出F的元素名称
(2)判断C、D、E原子半径的大小顺序
(3)写出单质D与C的最高价氧化物的水化物反应的离子方程式
(4)由A、B、C、E四种元素共同构成的两种化合物在溶液中相互间可发生化学反应,试写出该反应的离子方程式
考点:位置结构性质的相互关系应用
专题:物质的组成专题
分析:A、B、C、D、E为五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,B元素原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,则B最外层6,次外层为2,B为O元素,C与A同主族,且与E同周期,E元素的最外层电子数是次外层电子数的0.75倍,次外层为8个电子,最外层为6个电子,第一电子层为2个电子,且属于短周期元素,所以E是S元素,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成,则D是Al元素,A为H元素,C为Na元素,据此答题.
解答:
解:A、B、C、D、E为五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,B元素原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,则B最外层6,次外层为2,B为O元素,C与A同主族,且与E同周期,E元素的最外层电子数是次外层电子数的0.75倍,次外层为8个电子,最外层为6个电子,第一电子层为2个电子,且属于短周期元素,所以E是S元素,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成,则D是Al元素,A为H元素,C为Na元素,
(1)根据上面的分析可知,F为氯元素,B为氧元素,在周期表中第二周期第ⅥA族,故答案为:氯;第二周期第ⅥA族;
(2)电子层数相同,核电荷数越大,原子半径越小,所以C、D、E原子半径的大小顺序为Na>Al>S,由于硫的非金属性强于碳,所以硫化氢的稳定性大于甲烷,
故答案为:Na>Al>S;H2S>CH4;
(3)铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2 AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2 AlO2-+3H2↑;
(4)由A、B、C、E四种元素共同构成的两种化合物分别为NaHSO3和NaHSO4,在溶液中相互间可发生化学反应,反应的离子方程式为HSO3-+H+=H2O+SO2↑,
故答案为:HSO3-+H+=H2O+SO2↑.
(1)根据上面的分析可知,F为氯元素,B为氧元素,在周期表中第二周期第ⅥA族,故答案为:氯;第二周期第ⅥA族;
(2)电子层数相同,核电荷数越大,原子半径越小,所以C、D、E原子半径的大小顺序为Na>Al>S,由于硫的非金属性强于碳,所以硫化氢的稳定性大于甲烷,
故答案为:Na>Al>S;H2S>CH4;
(3)铝与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O=2 AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2 AlO2-+3H2↑;
(4)由A、B、C、E四种元素共同构成的两种化合物分别为NaHSO3和NaHSO4,在溶液中相互间可发生化学反应,反应的离子方程式为HSO3-+H+=H2O+SO2↑,
故答案为:HSO3-+H+=H2O+SO2↑.
点评:本题主要考查了元素周期表和元素周期律、离子反应等知识点,难度不大,解题的关键在于元素的推断,答题时注意审题,正确使用化学用语.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| B、大理石投入稀硝酸:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、铜片插入硝酸银溶液中:Cu2++Ag+=Cu2++Ag |
| D、澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O |
X、Y为两种短周期元素,Y的原子半径比X大.下列判断正确的是( )
| A、若X、Y同主族,则形成单质的熔沸点X>Y |
| B、若X、Y同周期,则第一电离能X>Y |
| C、若X、Y同主族,X、Y分别形成气态氢化物的稳定性X>Y |
| D、若X、Y同主族,X、Y分别形成简单离子的半径X<Y |
下列关于氯化氢和盐酸的叙述中正确的是( )
| A、他们都用HCl表示两者没有区别 |
| B、氯化氢和盐酸在潮湿的空气中都形成酸雾 |
| C、稀氯化氢和盐酸都能导电 |
| D、氯化氢是无色气体盐酸是无色溶液它们都有刺激性气味 |