题目内容
写出实验现象,按要求写离子方程式.
(1)向FeCl2溶液中加氨水,现象为 离子方程式 .
(2)向FeCl2溶液中加氯水,现象为 离子方程式 .
(3)向FeCl3溶液中加KSCN,现象为 离子方程式 .
(1)向FeCl2溶液中加氨水,现象为
(2)向FeCl2溶液中加氯水,现象为
(3)向FeCl3溶液中加KSCN,现象为
考点:离子方程式的书写
专题:
分析:(1)FeCl2和一水合氨反应生成白色沉淀Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成红褐色沉淀Fe(OH)3;
(2)FeCl2具有还原性,能被氯气氧化生成氯化铁;
(3)FeCl3和KSCN反应生成络合物硫氰化铁而使溶液呈血红色.
(2)FeCl2具有还原性,能被氯气氧化生成氯化铁;
(3)FeCl3和KSCN反应生成络合物硫氰化铁而使溶液呈血红色.
解答:
解:(1)FeCl2和一水合氨反应生成白色沉淀Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成红褐色沉淀Fe(OH)3,离子方程式为Fe2++2OH-=Fe(OH)2↓,看到的现象是先生成白色沉淀,迅速转化为灰绿色,最终转化为红褐色,
故答案为:先生成白色沉淀,迅速转化为灰绿色,最终转化为红褐色;Fe2++2OH-=Fe(OH)2↓;
(2)FeCl2具有还原性,能被氯气氧化生成氯化铁而使溶液呈黄色,离子方程式为2Fe2++Cl2=2Cl-+2Fe3+,故答案为:浅绿色溶液变为黄色;2Fe2++Cl2=2Cl-+2Fe3+;
(3)FeCl3和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,离子方程式为Fe3++3SCN-=Fe(SCN)3,看到的现象是溶液由黄色转化为血红色,故答案为:溶液由黄色转化为血红色;Fe3++3SCN-=Fe(SCN)3.
故答案为:先生成白色沉淀,迅速转化为灰绿色,最终转化为红褐色;Fe2++2OH-=Fe(OH)2↓;
(2)FeCl2具有还原性,能被氯气氧化生成氯化铁而使溶液呈黄色,离子方程式为2Fe2++Cl2=2Cl-+2Fe3+,故答案为:浅绿色溶液变为黄色;2Fe2++Cl2=2Cl-+2Fe3+;
(3)FeCl3和KSCN反应生成络合物硫氰化铁而使溶液呈血红色,离子方程式为Fe3++3SCN-=Fe(SCN)3,看到的现象是溶液由黄色转化为血红色,故答案为:溶液由黄色转化为血红色;Fe3++3SCN-=Fe(SCN)3.
点评:本题考查离子方程式的书写,明确物质的性质是解本题关键,知道常见物质的溶液颜色,知道铁离子、亚铁离子的检验方法及现象,题目难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、化学变化过程是原子的重新组合过程 |
| B、根据化学反应中的能量变化情况,化学反应可分为吸热反应和放热反应 |
| C、化学反应中能量变化多少与其反应物用量有关 |
| D、化学反应中的能量变化都是以热能形式表现出来的 |
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一.反应:2NO(g)+2CO(g)?2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570K时平衡常数为1×1059.下列说法正确的是( )
| A、提高尾气净化效率的最佳途径是研制高效催化剂 |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| D、570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳 |
X、Y为两种短周期元素,Y的原子半径比X大.下列判断正确的是( )
| A、若X、Y同主族,则形成单质的熔沸点X>Y |
| B、若X、Y同周期,则第一电离能X>Y |
| C、若X、Y同主族,X、Y分别形成气态氢化物的稳定性X>Y |
| D、若X、Y同主族,X、Y分别形成简单离子的半径X<Y |
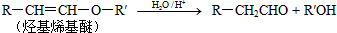

 .
.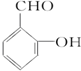 的属于芳香族化合物的两种官能团异构体的结构简式:
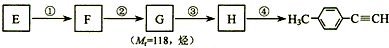
的属于芳香族化合物的两种官能团异构体的结构简式: )的一条路线如下
)的一条路线如下