题目内容
足量Cl2缓缓通入含0.02mol H2SO3和0.02mol HBr混合溶液中,在此过程中溶液的pH与Cl2用量的关系示意图是(溶液体积变化忽略不计,且不考虑Cl2与水反应)( )
A、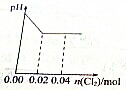 |
B、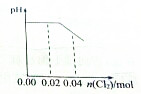 |
C、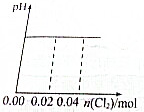 |
D、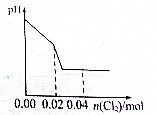 |
考点:氧化还原反应的计算,pH的简单计算
专题:
分析:亚硫酸根离子与溴离子都具有还原性,但是亚硫酸根离子还原性强于溴离子,通入氯气后,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-生成Br2.
解答:
解:亚硫酸根离子与溴离子都具有还原性,但是亚硫酸根离子还原性强于溴离子,通入氯气后,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-.
氯气氧化亚硫酸生成硫酸:
Cl2 +H2SO3 +H2O=H2SO4 +2HCl
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,PH值变小,H2SO3反应完毕,消耗 Cl20.02mol,再通氯气,然后再氧化Br-:
Cl2 +2HBr=Br2 +2HCl
0.01mol 0.02mol
HBr全部被氯气氧化转变为Br2 和HCl,则消耗了氯气为0.01mol,HCl和HBr都是强酸,所以c(H+)不变,即PH值不变;
故选:A.
氯气氧化亚硫酸生成硫酸:
Cl2 +H2SO3 +H2O=H2SO4 +2HCl
0.02mol 0.02mol 0.02mol 0.04mol
H2SO3为弱酸,生成两种强酸:H2SO4和HCl,c(H+)增大,PH值变小,H2SO3反应完毕,消耗 Cl20.02mol,再通氯气,然后再氧化Br-:
Cl2 +2HBr=Br2 +2HCl
0.01mol 0.02mol
HBr全部被氯气氧化转变为Br2 和HCl,则消耗了氯气为0.01mol,HCl和HBr都是强酸,所以c(H+)不变,即PH值不变;
故选:A.
点评:本题考查了氯气的性质已经有关氧化还原反应的计算,明确亚硫酸根离子与溴离子还原性强弱顺序是解题关键,难度不大.

练习册系列答案
相关题目
下列反应的离子方程式表示正确的是( )
| A、向Fe(NO3)3溶液中加入过量的HI溶液:2NO3+8H++6I═3I2+2NO↑+4H2O |
| B、硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| C、FeCl3溶液中通入过量的H2S气体:2Fe3++H2S═S↓+2Fe2++2H+ |
| D、NaHCO3溶液与过量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O |
X、Y为两种短周期元素,Y的原子半径比X大.下列判断正确的是( )
| A、若X、Y同主族,则形成单质的熔沸点X>Y |
| B、若X、Y同周期,则第一电离能X>Y |
| C、若X、Y同主族,X、Y分别形成气态氢化物的稳定性X>Y |
| D、若X、Y同主族,X、Y分别形成简单离子的半径X<Y |
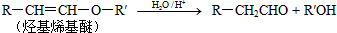

 .
.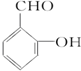 的属于芳香族化合物的两种官能团异构体的结构简式:
的属于芳香族化合物的两种官能团异构体的结构简式: )的一条路线如下
)的一条路线如下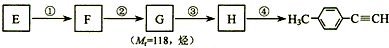
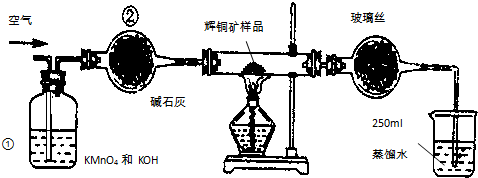
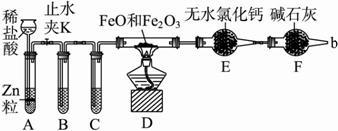
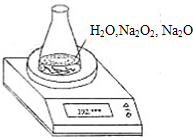 测某种含有少量氧化钠的过氧化钠试样的质量分数.
测某种含有少量氧化钠的过氧化钠试样的质量分数.