题目内容
16.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应.若生成硫酸钡沉淀的质量比为1:3:2,则三种硫酸盐的物质的量浓度之比为( )| A. | 1:2:3 | B. | 1:4:9 | C. | 1:9:6 | D. | 1:6:3 |
分析 生成硫酸钡沉淀的质量比为1:2:3,即生成硫酸钡的物质的量之比为1:2:3,然后利用Al2(SO4)3~3BaSO4、ZnSO4~BaSO4、Na2SO4~BaSO4来计算.
解答 解:由生成硫酸钡沉淀的质量比为1:2:3,即生成硫酸钡的物质的量之比为1:2:3,
设生成硫酸钡的物质的量分别为n、2n、3n,
则Al2(SO4)3~3BaSO4
1 3
$\frac{n}{3}$ n
ZnSO4~BaSO4
1 1
2n 2n
Na2SO4~BaSO4
1 1
3n 3n
又硫酸铝、硫酸锌、硫酸钠溶液的体积相同,
则浓度之比等于物质的量之比,即为$\frac{n}{3}$:3n:2n=1:9:6,
故选C.
点评 本题考查物质的量浓度的计算,明确反应中物质之间的关系是解答本题的关键,并熟悉同种物质的质量比等于物质的量之比、同体积的不同溶液的浓度之比等于物质的量之比来解答.

练习册系列答案
相关题目
7.试管壁上附着的硫可用CS2溶解清洗,也可倒入热的NaOH溶液将硫除掉,其反应方程式为3S+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O.反应中氧化剂和还原剂的质量比为( )
| A. | 2:7 | B. | 7:2 | C. | 2:1 | D. | 1:2 |
4.下列乙醇的化学性质不是由羟基决定的是( )
| A. | 跟金属钠反应 | |
| B. | 在足量氧气中完全燃烧生成CO2和H2O | |
| C. | 在浓硫酸存在时和乙酸发生酯化反应,生成乙酸乙酯和水 | |
| D. | 当银或铜存在时跟O2发生反应,生成乙醛和水 |
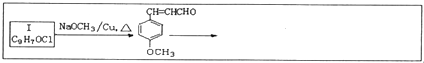
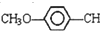 =CHCOOCH2CH2CH(CH3)2合成路线如下:
=CHCOOCH2CH2CH(CH3)2合成路线如下: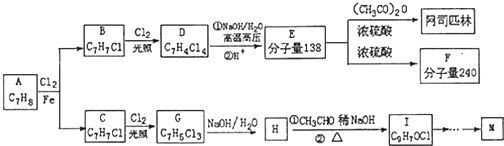
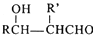 $\stackrel{△}{→}$RCH═
$\stackrel{△}{→}$RCH═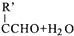
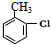 ,H→I两步反应的反应类型加成反应、消去反应
,H→I两步反应的反应类型加成反应、消去反应
 任意1种.
任意1种.