题目内容
7.试管壁上附着的硫可用CS2溶解清洗,也可倒入热的NaOH溶液将硫除掉,其反应方程式为3S+6NaOH$\frac{\underline{\;\;△\;\;}}{\;}$2Na2S+Na2SO3+3H2O.反应中氧化剂和还原剂的质量比为( )| A. | 2:7 | B. | 7:2 | C. | 2:1 | D. | 1:2 |
分析 反应3S+6NaOH═2Na2S+Na2SO3+3H2O中,S元素的化合价由0升高为+4价,S元素的化合价由0降低为-2价,硫既是氧化剂也是还原剂,根据氧化产物、还原产物判断氧化剂和还原剂的物质的量之比,都是S单质,质量之比等于物质的量之比,以此来解答.
解答 解:反应3S+6NaOH=2Na2S+Na2SO3+3H2O中,S元素化合价既升高又降低,硫既是氧化剂也是还原剂,
根据反应可知,若3molS参加反应,被还原生成2mol硫化钠,则做氧化剂的S为2mol,做还原剂的S为1mol,
所以氧化剂与还原剂的物质的量之比为2:1,由于都是S单质,则氧化剂与还原剂的质量比也是2:1,
故选C.
点评 本题考查氧化还原反应的计算,为高考常见题型,题目难度不大,明确氧化剂、还原剂的概念为解答关键,注意掌握氧化还原反应的特征、实质,试题侧重基础知识的考查,培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
17.下列叙述正确的是( )
| A. | 气体的摩尔体积约为22.4 mol•L-1 | |
| B. | 标准状况下9gH2O体积约为11.2L | |
| C. | 在100 mL水中溶解5.85 g NaCl,则所得NaCl溶液的物质的量浓度为1 mol•L-1 | |
| D. | 同温同压下,相同体积的任何气体所含物质分子的物质的量一定相同 |
15.下列物质按强电解质、弱电解质、酸性氧化物、碱性氧化物的组合中,正确的是( )
| 强电解质 | 弱电解质 | 酸性氧化物 | 碱性氧化物 | |
| A | H2SO4 | CH3COOH | NO2 | Na2O |
| B | BaSO4 | HClO | Mn2O7 | CaO |
| C | NaCl | 氨水 | SO2 | MnO2 |
| D | HI | HF | CO2 | Fe3O4 |
| A. | A | B. | B | C. | C | D. | D |
2.下列物质属于混合物的是( )
| A. | 液氯 | B. | 干冰 | C. | 海水 | D. | 碳酸钠 |
12.实验中的下列操作正确的是( )
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 | |
| D. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
19.已知:(1)H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(2)$\frac{1}{2}$N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
(3)$\frac{1}{2}$N2 (g)+$\frac{3}{2}$H2(g)═NH3(g)△H=-46.0kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热( )
(2)$\frac{1}{2}$N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
(3)$\frac{1}{2}$N2 (g)+$\frac{3}{2}$H2(g)═NH3(g)△H=-46.0kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热( )
| A. | 282.8 kJ/mol | B. | -282.8 kJ/mol | C. | 848.4kJ/mol | D. | -848.4 kJ/mol |
16.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应.若生成硫酸钡沉淀的质量比为1:3:2,则三种硫酸盐的物质的量浓度之比为( )
| A. | 1:2:3 | B. | 1:4:9 | C. | 1:9:6 | D. | 1:6:3 |
17.现有以下仪器:烧杯、铁架台(带铁夹和铁圈)、酒精灯、玻璃棒、分液漏斗、蒸发皿、蒸馏烧瓶、导管、量筒、500mL容量瓶,根据这些仪器,下列实验可以进行的是( )
| A. | 制取蒸馏水 | B. | 配置500 mL 0.5 mol/L NaCl溶液 | ||
| C. | 除去CaCO3中混有的少量NaCl | D. | 分离食盐水和CCl4的混合液 |
 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图1所示.又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属.②乙在甲中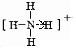 .
.