题目内容
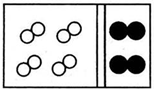
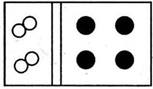
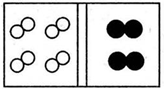
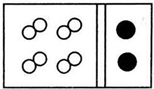
11.(1)某常见气体在标准状况下的密度为1.25g•L-1.请填空:①该气体的相对分子质量为28.
②若气体的化学式为A2型,其名称为氮气;若该气体的化学式为AB型,其名称为一氧化碳.
(2)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2═2NO2,充分反应后容器中氮原子和氧原子的个数之比为a:(a+2b).
分析 (1)该气体在标准状况下的密度为1.25g•L-1,M=ρVm,则A的相对分子质量为28,然后结合常见气体组成进行分析;
(2)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,据此计算出反应后容器中氮原子和氧原子的个数之比.
解答 解:(1)①该气体在标准状况下的密度为1.25g•L-1,M=ρVm=1.25g•L-1×22.4L/mol=28g/mol,则A的相对分子质量为28,
故答案为:28;
②若气体的化学式为A2型,则为氮气,若该气体的化学式为AB型,则为一氧化碳;
故答案为:氮气;一氧化碳;
(2)无论NO和氧气是否完全反应,即无论容器中存在的微粒是什么,但密闭容器中各种元素原子个数不变,
根据N=nNA知,各种元素的原子个数之比等于其物质的量之比,n(N):n(O)=n(NO):[n(NO)+2n(O2)]=amol:(a+2b)mol=a:(a+2b),
故答案为:a:(a+2b).
点评 本题考查物质的量的相关计算,题目难度不大,明确“各种元素原子个数与是否发生反应无关”是解本题关键,注意掌握密度与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
1.在一个恒容绝热的容器内发生反应:mA(g)+nB(g)?pC(s)+qQ(g)当m、n、p、q为任意数时,达到平衡的标志是:( )
①体系的气体密度不再改变 ②体系的温度不再改变 ③生成物C的浓度不再改变
④气体的总质量不再改变 ⑤反应速率n v(A)=m v(B)
⑥单位时间内m mol A断键反应,同时q mol Q也断键反应.
①体系的气体密度不再改变 ②体系的温度不再改变 ③生成物C的浓度不再改变
④气体的总质量不再改变 ⑤反应速率n v(A)=m v(B)
⑥单位时间内m mol A断键反应,同时q mol Q也断键反应.
| A. | ①②④⑤ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ①②④⑥ |
2.下列物质属于混合物的是( )
| A. | 液氯 | B. | 干冰 | C. | 海水 | D. | 碳酸钠 |
19.已知:(1)H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ/mol
(2)$\frac{1}{2}$N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
(3)$\frac{1}{2}$N2 (g)+$\frac{3}{2}$H2(g)═NH3(g)△H=-46.0kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热( )
(2)$\frac{1}{2}$N2 (g)+O2(g)═NO2(g)△H=+33.9kJ/mol
(3)$\frac{1}{2}$N2 (g)+$\frac{3}{2}$H2(g)═NH3(g)△H=-46.0kJ/mol
计算NH3(g)燃烧生成NO2(g)和H2O(g)的燃烧热( )
| A. | 282.8 kJ/mol | B. | -282.8 kJ/mol | C. | 848.4kJ/mol | D. | -848.4 kJ/mol |
16.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应.若生成硫酸钡沉淀的质量比为1:3:2,则三种硫酸盐的物质的量浓度之比为( )
| A. | 1:2:3 | B. | 1:4:9 | C. | 1:9:6 | D. | 1:6:3 |
20.在含有I-且能使石蕊试液变红的溶液中能大量共存的离子组为( )
| A. | Fe3+、Na+、Br- | B. | NH4+、Na+、AlO2- | C. | Ba2+、Al3+、Cl- | D. | K+、MnO4-、NO3- |