题目内容
3.磁性氧化铁(Fe3O4)可用于制造录音磁带和电讯器材,其溶于稀硝酸的化学方程式为:3Fe3O4+28HNO3(稀)═9Fe(NO3)2+NO↑+14H2O.
(1)Fe3O4晶体的颜色为黑色.
(2)Fe(NO3)2在水溶液中的电离方程式为Fe(NO3)2=Fe3++3NO3-.
(3)上述反应中,氧化剂是HNO3(填化学式),被还原的氮元素与未被还原的氮元素的物质的量之比为1:27,每生成2.24L(标准状况下)NO时,转移电子的物质的量为0.3mol.
分析 (1)Fe3O4是黑色晶体;
(2)Fe(NO3)2在水溶液中完全电离,电离出Fe3+、NO3-;
(3)所含元素化合价降低的反应物为氧化剂;
被还原的氮元素转化为NO,未被还原的氮元素转化为Fe(NO3)2,结合方程式判断;
反应中只有N原子化合价降低,根据N元素化合价变化计算转移电子物质的量.
解答 解:(1)Fe3O4晶体的颜色为黑色,故答案为:黑色;
(2)Fe(NO3)2在水溶液中完全电离,电离出Fe3+、NO3-,电离方程式为:Fe(NO3)2=Fe3++3NO3-,
故答案为:Fe(NO3)2=Fe3++3NO3-;
(3)反应中HNO3中部分N元素化合价降低,Fe3O4中部分Fe元素化合价升高,故HNO3是氧化剂;
被还原的氮元素转化为NO,未被还原的氮元素转化为Fe(NO3)2,结合方程式可知被还原的氮元素与未被还原的氮元素的物质的量之比为1:27;
反应中只有N元素化合价由+5价降低为+2价,生成NO为$\frac{2.24L}{22.4L/mol}$=0.1mol,转移电子物质的量为0.1mol×(5-2)=0.3mol,
故答案为:HNO3;1:27;0.3.
点评 本题考查氧化还原反应基本概念与计算、电离方程式书写、铁的氧化物等,比较基础,注意根据化合价理解氧化还原反应基本概念.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
13.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲$\stackrel{丁}{→}$乙$\stackrel{丁}{→}$丙.下列4种推断正确的是( )
①若甲为氨气,则丁可能是O2
②若丁是氢氧化钠溶液,则甲可能是一种能使品红溶液褪色的气体
③若甲为碳,则丙在一定条件下可与甲反应
④若甲为硝酸银溶液,则乙可能是一种沉淀.
①若甲为氨气,则丁可能是O2
②若丁是氢氧化钠溶液,则甲可能是一种能使品红溶液褪色的气体
③若甲为碳,则丙在一定条件下可与甲反应
④若甲为硝酸银溶液,则乙可能是一种沉淀.
| A. | ①②④ | B. | ①②③④ | C. | ①②③ | D. | ①③④ |
14.如表各组物质中,Y是X物质中含有的少量杂质,Z是除杂试剂,其中所加试剂最合理的一组是( )
| X | Y | Z | |
| A | NaHCO3溶液 | Na2CO3 | Ba(OH)2溶液 |
| B | Fe2O3 | Al2O3 | NaOH溶液 |
| C | FeCl3溶液 | CuCl2 | Fe |
| D | Na2SO4溶液 | Na2CO3 | 盐酸 |
| A. | A | B. | B | C. | C | D. | D |
11.运用铝及其化合物有关知识,回答下列问题:
(1)如图1四个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A~D中选择符合各题要求的序号填入表
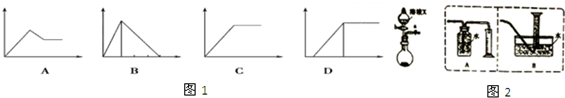
(2)测定某镁铝合金中铝含量的实验装置图如图2(夹持仪器略).
实验步骤:
步骤1:连接装置并检查装置气密性;
步骤2:称取mg镁铝合金样品置于烧瓶中,在分液漏斗中盛放足量的溶液X;
步骤3:打开分液漏斗活塞b,使反应进行,待不再产生气泡时关闭活塞b;
步骤4:待装置冷却后,调平量筒与水槽的液面,读取气体体积为xmL(折合成标准状况下干燥气体的体积).
①测定氢气体积的装置选择A(填A或B)
②为了使合金中的铝与X反应,而Mg不反应,X应选用NaOH(填化学式),反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.③计算合金中铝的质量分数为$\frac{54x}{67.2m×1{0}^{3}}$(用m,x的代数式表示).
(1)如图1四个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A~D中选择符合各题要求的序号填入表

| 溶液 | 加入的物质 | 答案序号 |
| AlCl3溶液 | 通入过量的NH3 | ① |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ② |
| NaAlO2溶液 | 滴加稀H2SO4至过量 | ③ |
| MgCl2和AlCl3的混合液 | 滴加NaOH溶液至过量 | ④ |
实验步骤:
步骤1:连接装置并检查装置气密性;
步骤2:称取mg镁铝合金样品置于烧瓶中,在分液漏斗中盛放足量的溶液X;
步骤3:打开分液漏斗活塞b,使反应进行,待不再产生气泡时关闭活塞b;
步骤4:待装置冷却后,调平量筒与水槽的液面,读取气体体积为xmL(折合成标准状况下干燥气体的体积).
①测定氢气体积的装置选择A(填A或B)
②为了使合金中的铝与X反应,而Mg不反应,X应选用NaOH(填化学式),反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.③计算合金中铝的质量分数为$\frac{54x}{67.2m×1{0}^{3}}$(用m,x的代数式表示).
18.2015年10月,屠呦呦因发现青蒿素和双氢青蒿素治疗疟疾的新疗法而获得诺贝尔生理学或医学奖.双氢青蒿素的化学式为C15H24O5,相对分子质量为284.下面关于双氢青蒿素的说法正确的是( )
| A. | 1mol双氢青蒿素的质量为284g?mol-1 | |
| B. | 双氢青蒿素的摩尔质量等于它的相对分子质量 | |
| C. | 14.2g双氢青蒿素中含有的原子总数为2.2NA | |
| D. | 含有6.02×1023个碳原子的双氢青蒿素的物质的量为1mol |
8.某有机物甲在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则甲( )
| A. | 分子中C、H、O的原子个数之比一定为1:4:4 | |
| B. | 一定为烃类 | |
| C. | 分子中一定含有氧原子 | |
| D. | 分子式为CH4Ox(x=0、1) |
15.下列试剂,既能与Na2CO3溶液反应,又能与NaHCO3的是( )
| A. | CaCl2溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | Ba(OH)2溶液 |
12.如表各组溶液电解一段时间后,再加入相关物质,溶液能恢复原来组成的是( )
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |
13.用下列实验装置进行相应实验,能达到实验目的是( )
| A. |  分离乙醇和乙酸混合溶液 | B. |  石油分馏 | ||
| C. |  电解精炼铜 | D. |  实验室用乙醇制取乙烯 |