题目内容
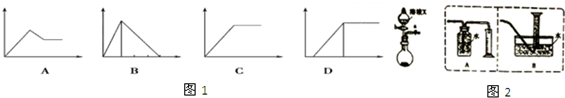
11.运用铝及其化合物有关知识,回答下列问题:(1)如图1四个图中,横坐标表示加入的物质的量,纵坐标表示生成沉淀的量,从A~D中选择符合各题要求的序号填入表
| 溶液 | 加入的物质 | 答案序号 |
| AlCl3溶液 | 通入过量的NH3 | ① |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ② |
| NaAlO2溶液 | 滴加稀H2SO4至过量 | ③ |
| MgCl2和AlCl3的混合液 | 滴加NaOH溶液至过量 | ④ |
实验步骤:
步骤1:连接装置并检查装置气密性;
步骤2:称取mg镁铝合金样品置于烧瓶中,在分液漏斗中盛放足量的溶液X;
步骤3:打开分液漏斗活塞b,使反应进行,待不再产生气泡时关闭活塞b;
步骤4:待装置冷却后,调平量筒与水槽的液面,读取气体体积为xmL(折合成标准状况下干燥气体的体积).
①测定氢气体积的装置选择A(填A或B)
②为了使合金中的铝与X反应,而Mg不反应,X应选用NaOH(填化学式),反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.③计算合金中铝的质量分数为$\frac{54x}{67.2m×1{0}^{3}}$(用m,x的代数式表示).
分析 (1)①氯化铝中加入氨水生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中;
②NaOH和NaAlO2的混合溶液中通入二氧化碳,先发生氢氧化钠与二氧化碳的反应,不生成沉淀,再发生NaAlO2与二氧化碳反应,生成沉淀;
③NaAlO2溶液中加入稀盐酸,先生成氢氧化铝沉淀,后沉淀溶解,根据方程式判断前后两部分两部分消耗的盐酸体积;
④MgCl2和AlCl3混合溶液中滴加NaOH溶液生成两种沉淀,然后氢氧化铝与碱反应使沉淀的量减少,但不会完全溶解;
(2)①测定生成氢气的体积,可利用排水法收集氢气,并通过测定排出水的体积确定生成氢气的体积;
②为了使合金中的铝与氢氧化钠反应,而氢氧化钠与Mg不反应,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
③根据反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,来计算铝的质量,结合w%=$\frac{铝的质量}{合金的质量}×100%$.
解答 解:(1)①氯化铝中加入氨水生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,发生的反应为Al3++3OH-═Al(OH)3↓,故图象C符合;
②NaOH和NaAlO2的混合溶液中通入二氧化碳,先发生反应2NaOH+CO2═Na2CO3+2H2O,开始不产生沉淀,NaOH溶液完毕,再发生2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,生成沉淀,故图象D符合;
③NaAlO2溶液中加入稀盐酸,发生反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成氢氧化铝沉淀,NaAlO2反应完毕后,发生反应,Al(OH)3+3HCl=AlCl3+3H2O,氢氧化铝溶解,前后两部分消耗的盐酸体积为1:3,故图象B符合;
④MgCl2和AlCl3混合溶液中滴加NaOH溶液发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,沉淀量减少但不会完全溶解,故图象A符合;
故答案为:①:C;②:D;③:B;④:A;
(2)①测定生成氢气的体积,可利用排水法收集氢气,并通过测定排出水的体积确定生成氢气的体积,故选:A;
②为了使合金中的铝与氢氧化钠反应,而氢氧化钠与Mg不反应,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为:NaOH;2Al+2OH-+2H2O=2AlO2-+3H2↑;
③根据反应方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
54g 3×22.4×103
m(Al) x
所以$\frac{54g}{m(Al)}=\frac{3×22.4×1{0}^{3}}{x}$,所以m(Al)=$\frac{54x}{67.2×1{0}^{3}}$,w%=$\frac{铝的质量}{合金的质量}×100%$=$\frac{\frac{54x}{67.2×1{0}^{3}}}{m}×100%$=$\frac{54x}{67.2m×1{0}^{3}}$,故答案为:$\frac{54x}{67.2m×1{0}^{3}}$.
点评 本题以图象显示考查化学反应和相关计算型实验的考查,难度中等,明确发生的化学反应是解答的关键,注意图象中前后两部分的比例关系.

| A. | 将稀硫酸改成浓硫酸 | B. | 滴加少量硫酸钠溶液 | ||
| C. | 硫酸改成4 mol•L-1的醋酸 | D. | 滴加几滴硫酸铜溶液 |
| A. | 分液、蒸馏、萃取 | B. | 萃取、蒸发、分液 | C. | 分液、萃取、蒸馏 | D. | 蒸馏、萃取、分液 |
| A. | 22.4LCO和CO2的混合气体中所含的碳原子数一定是NA | |
| B. | 含1molHCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA | |
| C. | 常温常压下,32gO2和32gO3所含氧原子数都是2NA | |
| D. | 1mol/L的Na2SO4溶液中含2NA个Na+ |
| A. | Na2O2、KOH、CaO | B. | CO、NaOH、KCl | C. | H2O、H2SO4、NaCl | D. | CuO、Na2O2、CaCO3 |
| A. | 无色溶液中:NH4+、Cu2+、CO32-、Cl- | |
| B. | 中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3- | |
| C. | pH值为1的溶液:Na+、Al3+、CH3COO-、SO42- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br- |