题目内容
2.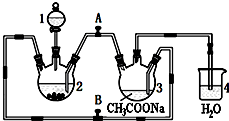 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:
醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
(1)仪器1的名称是分液漏斗.
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是D(选下面的A、B或C);目的是让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化.
A.盐酸和三氯化铬溶液同时加入 B.先加三氯化铬溶液一段时间后再加盐酸 C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门B(填“A”或“B”,下同),打开阀门A.
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是过量的锌与CrCl3充分反应得到CrCl2.
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.4g,则该实验所得产品的产率为83.3%(不考虑溶解的醋酸亚铬水合物).
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的空气或氧气,再加入碱液,调节pH至少为5.6才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L).已知Cr(OH)3的溶度积为6.3×10-31,$\root{3}{63}$≈4,lg2≈0.3】
分析 (1)根据仪器结构特征,可知仪器1为分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合;
(4)过量的锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,根据CrCl2计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率;
(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31计算溶液中c(OH-),再结合水的离子积计算c(H+),溶液pH=-lgc(H+).
解答 解:(1)根据仪器结构特征,可知仪器1为分液漏斗,
故答案为:分液漏斗;
(2)二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,
故答案为:C;让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化;
(3)利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,
故答案为:B;A;
(4)锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是:过量的锌与CrCl3充分反应得到CrCl2,
故答案为:过量的锌与CrCl3充分反应得到CrCl2;
(5)CrCl3为$\frac{9.51g}{158.5g/mol}$=0.06mol,得到CrCl2为0.06mol,而CH3COONa为1.5mol,由方程式可知CH3COONa足量,则得到[Cr(CH3COO)2]2•2H2O为0.06mol×$\frac{1}{2}$×376g/mol=11.28g,所得产品的产率为
$\frac{9.4g}{11.28g}$×100%=83.3%,
故答案为:83.3%;
(6)向废液中通入足量的空气或氧气,将Cr2+氧化为Cr3+,铬的离子沉淀完全时,浓度应小于10-5mol/L,根据Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=6.3×10-31,此时溶液中c(OH-)=4×10-9,溶液pH=-lgc(H+)=-lg$\frac{1{0}^{-14}}{4×1{0}^{-9}}$=5.6,
故答案为:空气或氧气;5.6.
点评 本题考查物质制备实验,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等,注意对题目信息的应用,有利于培养学生分析能力、实验能力,题目难度中等.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | CuSO4→Cu | B. | Mg→Mg3N2 | C. | S→SO2 | D. | SiO2→Na2SiO3 |
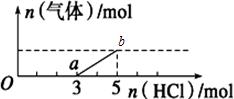
下列说法不正确是( )
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈酸性(填“酸性”、“中性”或“碱性”),溶液中c(Na+)<c (CH3COO-)(填“>”、“=”或“<”).
(2)25℃时,向0.l mol•L-1的醋酸中加入少量醋酸钠固体,当固体溶解后,测得溶液pH增大,主要原因是醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小.
(3)室温下,如果将0.lmol CH3COONa固体和0.05mol HCl全部溶于水形成混合溶液中:CH3COOH和CH3COO-两种粒子的物质的量之和等于0.lmol.
(4)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是A.
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定达终点时,发现滴定管尖嘴部分有气泡
(5)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如表实验.资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI.
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
②步骤3中现象a是出现白色沉淀;
③用化学平衡原理解释步骤4的实验现象AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
| A. | 0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA | |
| C. | 92 g NO2和N2O4混合气体中含有氧原子总数为4NA | |
| D. | 标况下,22.4升SO3含有原子总数为4 NA |
| A. | 硫酸生产中常采用高压条件提高SO2的转化率 | |
| B. | 合成氨中采用及时分离氨气提高反应速率 | |
| C. | 电解精炼铜时,溶液中c(Cu2+)会略有减小 | |
| D. | 氯碱工业电解饱和食盐水时,阳极得到氢氧化钠和氢气 |
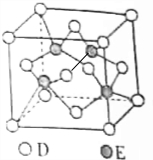 原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.
原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.