题目内容
4.向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系正确的是( )| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 2 | 2 | 3 | 3 |
| A. | A | B. | B | C. | C | D. | D |
分析 CO2通入到NaOH、Ba(OH)2、NaAlO2的混合溶液,反应的先后顺序为:Ba(OH)2、NaOH、NaAlO2,含有NaOH、Ba(OH)2、NaAlO2的混合溶液中慢慢通入CO2,发生的反应有:CO2+Ba(OH)2=BaCO3↓+H2O;2NaOH+CO2=Na2CO3+H3O;2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3;若二氧化碳过量,还发生Na2CO3+CO2+H2O=2NaHCO3 ,BaCO3+CO2+H2O=Ba(HCO3)2,据此结合反应的方程式进行计算.
解答 解:A.通入2mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗1mol二氧化碳,生成1mol碳酸钡沉淀,剩余的1mol二氧化碳与2mol氢氧化钠反应恰好反应,CO2+2NaOH=Na2CO3+H2O,则沉淀只有1mol,故A错误;
B.当通入的n(CO2)=3 mol时,发生的离子反应是Ba2++2OH-+CO2=BaCO3↓+H2O、2OH-+CO2=CO32-+H2O、2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,所以产生的沉淀是BaCO3和Al(OH)3且n(沉淀)之和是3mol(1mol BaCO3和2mol Al(OH)3),故B错误;
C.通入4mol二氧化碳,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,消耗1mol二氧化碳,生成1mol碳酸钡沉淀,剩余3mol二氧化碳与氢氧化钠发生反应:CO2+NaOH=NaHCO3,消耗二氧化碳2mol,最后1mol二氧化碳与Na[Al(OH)4]发生反应2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,生成2mol氢氧化铝沉淀,故生成沉淀总物质的量为3mol,故C正确;
D.当通入6mol二氧化碳,分别发生反应Ba(OH)2+CO2=BaCO3↓+H2O,CO2+NaOH=NaHCO3,2NaAlO2+3H2O+CO2=2Al(OH)3↓+Na2CO3,生成1mol碳酸钡、2mol氢氧化铝沉淀,2mol碳酸氢钠,1mol碳酸钠,消耗4mol二氧化碳,剩余的2mol二氧化碳分别与生成的1mol碳酸钠和1mol碳酸钡沉淀发生反应:Na2CO3+CO2+H2O=2NaHCO3 ,BaCO3+CO2+H2O=Ba(HCO3)2,所以最后剩余沉淀的物质的量为2mol,故D错误;
故选C.
点评 本题考查了混合物反应的计算,题目难度中等,明确反应的先后顺序是解题的关键,注意二氧化碳与碱反应量的关系对反应的影响,试题培养了学生的分析能力及化学计算能力.

| A. | 通入NO2:Na+、Fe2+、Cl-、SO42- | B. | 通入CO2:Na+、K+、NO3-、CO32- | ||
| C. | 通入NH3:CO32-、NH4+、Na+、NO3- | D. | 通入Cl2:K+、NH4+、I-、Cl- |
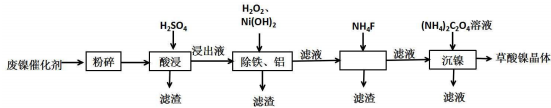
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaCO3)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni3+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).
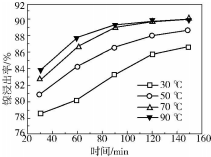
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
| A. | CuSO4→Cu | B. | Mg→Mg3N2 | C. | S→SO2 | D. | SiO2→Na2SiO3 |
| A. | HA溶液中加入NaA固体后,$\frac{{c(HA)c(O{H^-})}}{{c({A^-})}}$减小 | |
| B. | 常温下,0.1mol/LHA溶液中水电离的c(H+)为10-13mol/L | |
| C. | NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A-)+c(Cl-) | |
| D. | 常温下,0.1mol/LNaA溶液水解常数为10-9 |
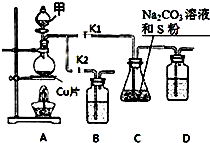 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.