题目内容
17.如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )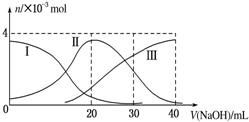
| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-?H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) |
分析 A、当V(NaOH)=20mL时,溶液中HA-的量最大,故H2A是弱电解质,H2A在水中的电离方程式是:H2A?H++HA-、HA-?H++A2-;
B、根据图象知,当V(NaOH)=20时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,电离为主,溶液显酸性;
C、酸或碱抑制水电离,含有弱根离子的盐水解促进水电离;
D、当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒和物料守恒.
解答 解:A、当V(NaOH)=20mL时,溶液中HA-的量最大,故H2A是弱电解质,H2A在水中的电离方程式是:H2A?H++HA-、HA-?H++A2-,故A错误;
B、当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故B正确;
C、由图示关系知,c(A2-)>c(H2A),说明电离大于水解程度,溶液显酸性,水的电离受到了抑制,故C错误;
D、当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)①,物料守恒可知:3c(HA-)+3c(A2-)+3c(H2A)=2c(Na+)②,①×2+②得:2c(H+)+c(HA-)+3c(H2A)═c(A2-)+2c(OH-),故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,侧重于学生的分析能力的考查,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,抓住图象进行分析即可,题目难度中等.

| A. | 锥形瓶用蒸馏水洗涤后,再用氢氧化钠溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,即装入标准盐酸进行滴定 | |
| C. | 滴定时,边摇动锥形瓶边观察瓶中溶液的颜色变化 | |
| D. | 当滴定至溶液由黄色变为橙色时,即为滴定终点 |
①加少量CH3COONH4固体②加少量H2SO4③加少量冰醋酸④加少量NaOH固体⑤升高温度⑥降低温度( )
| A. | ②⑤ | B. | ①③⑥ | C. | ②③⑤ | D. | ①③ |
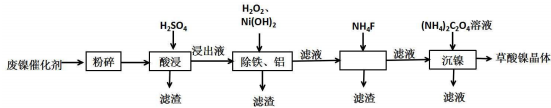
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaCO3)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni3+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).
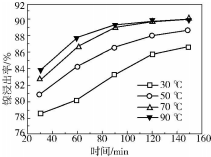
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
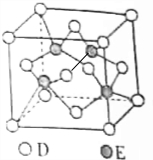 原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.
原子序数递增的主族元素A、B、C、D、E,已知B的单质是生活中最常见的金属之一,该元素与同主族元素A、D原子的核电荷数分别相差8和18,C元素的最高价氧化物的水化物属于最强无机酸,E与D同周期,E的气态基态原子第一电离能大于同周期相邻主族元素.