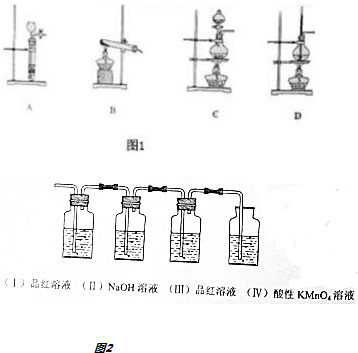
题目内容
1.已知HCN为弱酸,在0.1mol•L-1的KCN溶液中,下列关系不正确的是( )| A. | c(K+)>c(CN-) | B. | c(CN-)>c(HCN) | ||
| C. | c(HCN)+c(CN-)=0.2mol•L-1 | D. | c(K+)+c(H+)=c(CN-)+c(OH-) |
分析 A.CN-在溶液中发生水解;
B.CN-在溶液中的水解程度较小;
C.根据物料守恒分析;
D.根据电荷守恒分析.
解答 解:A.CN-在溶液中发生水解,c(CN-)会减小,所以c(K+)>c(CN-),故A正确;
B.CN-在溶液中的水解程度较小,水解生成的HCN的浓度较小,所以c(CN-)>c(HCN),故B正确;
C.在0.1mol•L-1的KCN溶液中物料守恒为:c(HCN)+c(CN-)=0.1mol•L-1,故C错误;
D.溶液中存在电荷守恒,即c(K+)+c(H+)=c(CN-)+c(OH-),故D正确.
故选C.
点评 本题考查了弱电解质的电离和盐的水解,题目难度不大,注意把握溶液中离子浓度大小比较方法和电荷守恒、物料守恒的应用,侧重于考查学生的分析能力.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
9.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如图:
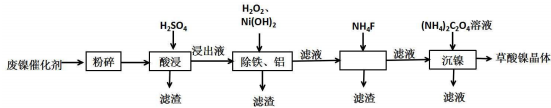
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaCO3)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)“粉碎”的目的是增大接触面积,加快反应速率,提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).
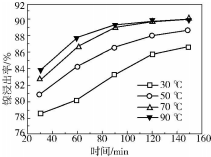
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaCO3)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni3+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
(3)将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
16.对于反应:3BrF3+5H2O=Br2+HBrO3+O2+9HF,下列说法正确的是( )
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
13.下列变化中,需加还原剂才能实现的是( )
| A. | CuSO4→Cu | B. | Mg→Mg3N2 | C. | S→SO2 | D. | SiO2→Na2SiO3 |
10.将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)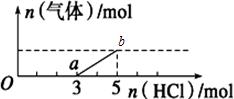
下列说法不正确是( )

下列说法不正确是( )
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
11.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 0.1 mol Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 0.1 mol/L Na2SO4溶液中,含有SO42- 数为0.1NA | |
| C. | 92 g NO2和N2O4混合气体中含有氧原子总数为4NA | |
| D. | 标况下,22.4升SO3含有原子总数为4 NA |