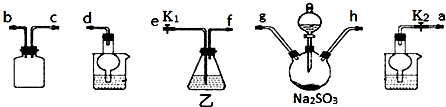题目内容
20. 碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.
碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等.I.制备
碱式碳酸铜因生成条件不同,其颜色和组成也不尽相同,即:碱式碳酸铜中Cu(OH)2和CuCO3的比例不同.某实验小组设计以下不同实验制备碱式碳酸铜.
(1)由Na2CO3•10H2O与CuSO4•5H2O反应制备:称取14.0g CuSO4•5H2O、16.0g Na2CO3•10H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”.将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体.
①混合物发生反应时有“嗞嗞”声的原因是有CO2气体生成.
②撤离热源的目的是防止碱式碳酸铜受热分解.
③检验滤液中是否含有SO42-的方法是取最后一次洗涤液于试管中,先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,否则没有.
(2)由Na2CO3溶液与CuSO4溶液反应制备:分别按一定比例取CuSO4溶液和Na2CO3溶液,水浴加热到设定温度后,在充分振荡下采用将CuSO4 溶液加入Na2CO3溶液或将Na2CO3溶液加入CuSO4 溶液的加料顺序进行实验.影响产品组成和产率的因素可能有温度、反应物配比、加料顺序.(列1 点)
Ⅱ.组成测定
有同学查阅资料发现用Cu(OH)2•CuCO3 表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2•nCuCO3,不同来源的碱式碳酸铜的m、n 值需要具体测定.
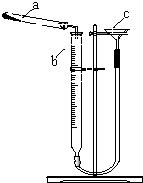
(3)热分解法测定碱式碳酸铜组成的实验装置如图所示.通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m 和n 的比值.
①仪器c 的名称是漏斗.
②检查装置气密性的方法是连接好装置,通过漏斗向装置中加水,至漏斗中水面比量气管中高,静置,水面不发生变化则装置不漏气,否则装置漏气.
③三次平行实验测定结果如下表,则该样品中m:n=3:2,若量气管中所盛液体为水,则该测定值比理论值偏大(填“偏大”、“偏小”或“不变”).
| 实验序号 | 样品质量/g | CO2体积/mL(已折算成标准状况下) |
| 1 | 0.542 | 44.82 |
| 2 | 0.542 | 44.80 |
| 3 | 0.542 | 44.78 |
分析 (1)①用研钵分别研细后再混合研磨,发生水解反应,有CO2气体生成,产生大量气泡,有“磁磁”的声音,而且混合物吸湿很厉害,很快成为“黏胶状”;
②碱式碳酸铜不稳定,受热容易分解;
③向用盐酸酸化,再用氯化钡溶液检验;
(2)由题目信息可知:产物的组成与反应物配比、加料顺序、温度等有关,从而使碱式碳酸铜中Cu(OH)2和CuCO3的比例不同;
(3)①由仪器结构特征可知,仪器c为漏斗;
②要进行其气密性检查,使试管不直接通过量气管与大气相通,需要用水(或液体)做液封,再利用液面高度差判断;
③先判断三次平行实验数据的有效性,然后求出平均值,然后根据方程式mCu(OH)2•nCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)CuO+mH2O+nCO2↑求出$\frac{m}{n}$的值;若量气管中所盛液体为水,二氧化碳溶于水,n值偏小,则m值偏大.
解答 解:(1)①用研钵分别研细后再混合研磨,发生水解反应,有CO2气体生成,产生大量气泡,所以会有“磁磁”的声音,
故答案为:有CO2气体生成;
②由于碱式碳酸铜受热容易分解,故应迅速撤离热源,防止其分解,
故答案为:防止碱式碳酸铜受热分解;
③滤液中是否含有SO42-的操作方法是:取最后一次洗涤液于试管中,先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,否则没有;
故答案为:取最后一次洗涤液于试管中,先加入盐酸酸化,再加入BaCl2溶液,若有BaSO4白色沉淀产生,则证明有SO42-,否则没有;
(2)产物的组成与反应物配比、加料顺序、温度等有关,从而使碱式碳酸铜中Cu(OH)2和CuCO3的比例不同,
故答案为:反应物配比、加料顺序;
(3)①仪器c的名称是漏斗;
故答案为:漏斗;
②检验装置的气密性具体方法:连接好装置,通过漏斗向装置中加水,至漏斗中水面比量气管中高,静置,水面不发生变化则装置不漏气,否则装置漏气;
故答案为:连接好装置,通过漏斗向装置中加水,至漏斗中水面比量气管中高,静置,水面不发生变化则装置不漏气,否则装置漏气;
③三次平行实验数据均有效,CO2体积的平均值$\frac{44.82+44.78+44.80}{3}$mL=44.80mL,物质的量为$\frac{0.0448L}{22.4L/mol}$=0.002mol,
mCu(OH)2•nCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(m+n)CuO+mH2O+nCO2
(98m+124n)g nmol
0.542g 0.002mol
所以(98m+124n)g:0.542g=nmol:0.002mol
整理可得:m:n=3:2;
若量气管中所盛液体为水,二氧化碳溶于水,n值偏小,则m值偏大,m与n的比值偏大,
故答案为:3:2;偏大.
点评 本题考查物质的制备与组成测定,侧重对实验现象的分析、问题讨论的考查,综合考查学生对知识的迁移应用,注意掌握气密性检验原理,难度中等.

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案| A. | 淀粉发酵 | B. | 乙烯加水 | C. | 乙醛还原 | D. | 乙酸乙酯水解 |
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaCO3)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni3+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).
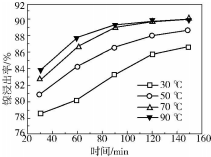
a.30℃、30min b.90℃、150min
c.70℃、120min d.90℃、120min
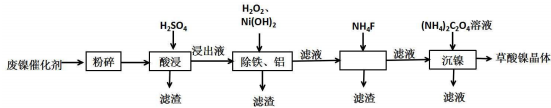
(3)将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
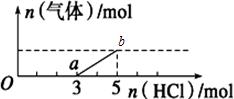
下列说法不正确是( )
| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 标准状况下,通入CO2的体积为4.48L | |
| C. | ab段反应的离子方程式为:HCO${\;}_{3}^{-}$+H+=CO2↑+H2O | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol•L-1 |
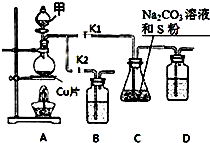 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.