题目内容
若将某种富含维生素C的水果切碎捣烂,加水溶解,提取其滤液就能达到充分提取水果中的维生素c的目的,这说明服用维生素c可使食物中的Fe3+转化成Fe2+,有利于人体吸收,在该化学反应中维生素c体现( )
| A、能溶于水,氧化性 |
| B、不能溶于水,氧化性 |
| C、能溶于水,还原性 |
| D、不能溶于水,还原性 |
考点:氧化还原反应
专题:
分析:由亚硝酸钠导致血红蛋白中的Fe2+转化为高铁血红蛋白而中毒,服用维生素C可解除亚硝酸钠中毒,则服用维生素C中某元素的化合价升高,以此来解答.
解答:
解:提取其滤液就能达到充分提取水果中的维生素c的目的,这说明维生素c能溶于水,若要想使生成的Fe3+重新转化为Fe2+,铁元素化合价降低,得到电子,发生还原反应,服用维生素C可以解毒,说明维生素C能够失去电子,具有还原性,故A、B、D错误;
故选C.
故选C.
点评:本题考查氧化还原反应,为高频考点,侧重于基本概念的考查,明确反应中元素的化合价变化是解答本题的关键,注重利用信息与氧化还原反应中的概念来解答,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
下列关于氯水的叙述,正确的是( )
| A、新制的氯水中只含有Cl2和H2O分子 |
| B、新制的氯水可使蓝色石蕊试纸先变蓝后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后,pH值变小,漂白能力变弱 |
根据以下反应判断:Fe3+、Fe2+、Cu2+的氧化性强弱顺序是( )
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
①Fe+CuCl2=Cu+FeCl2
②2FeCl3+Cu=CuCl2+2FeCl2.
| A、Fe2+>Cu2+>Fe3+ |
| B、Fe3+>Fe2+>Cu2+ |
| C、Fe3+>Cu2+>Fe2+ |
| D、Cu2+>Fe2+>Fe3+ |
某溶液中存在大量的H+、NO3-、Cl-,该溶液中还可能大量存在的离子是( )
| A、CO32- |
| B、OH- |
| C、Ag+ |
| D、SO42- |
下列说法正确的是( )
| A、S2-电子排布式 1s22s22p63s23p4 |
| B、在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 |
| C、金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 |
D、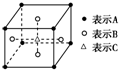 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. |
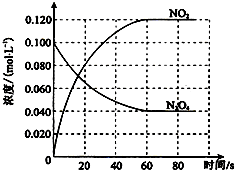 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4g)═2NO2 (g),随温度升高,混合气体的颜色变深.