题目内容
在密闭容器中进行如下反应:H2(g)+I2(g)?2HI(g),已知H2、I2、HI、的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、HI为0.3mol/L |
| B、I2为0.4mol/L |
| C、H2为0.2mol/L |
| D、HI为0.4mol/L |
考点:化学反应的可逆性
专题:化学平衡专题
分析:化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,
若反应向正反应进行到达平衡,I2、H2的浓度最小,HI的浓度最大;
若反应逆正反应进行到达平衡,I2、H2的浓度最大,HI的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
若反应向正反应进行到达平衡,I2、H2的浓度最小,HI的浓度最大;
若反应逆正反应进行到达平衡,I2、H2的浓度最大,HI的浓度最小;
利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答:
解:若反应向正反应进行到达平衡,H2、I2的浓度最小,HI的浓度最大,假定完全反应,则:
H2(g)+I2(g)?2HI(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,H2、I2的浓度最大,HI的浓度最小,假定完全反应,则:
H2(g)+I2(g)?2HI(g),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(H2)<0.2,0.2<c(I2)<0.4,0<c(HI)<0.4,
故选A.
H2(g)+I2(g)?2HI(g)
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0 0.2 0.4
若反应逆正反应进行到达平衡,H2、I2的浓度最大,HI的浓度最小,假定完全反应,则:
H2(g)+I2(g)?2HI(g),
开始(mol/L):0.1 0.3 0.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.4 0
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(H2)<0.2,0.2<c(I2)<0.4,0<c(HI)<0.4,
故选A.
点评:本题考查了化学平衡的建立,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.

练习册系列答案
相关题目
有些垃圾可以用卫生填埋、焚烧、堆肥等方法处理.下列垃圾中,不适宜用上述方法处理的是( )
| A、果核 | B、电池 |
| C、卫生纸 | D、纯棉纺织品 |
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A、Na2CO3和HCl |
| B、AlCl3和NaOH |
| C、NaAlO2和H2SO4 |
| D、Ba(HCO3)2和Ba(OH)2 |
关于如图所示装置的叙述,正确的是( )
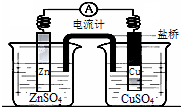

| A、铜是阳极,铜片上有气泡产生 |
| B、盐桥中的阳离子会移向CuSO4溶液 |
| C、正极附近的SO42-离子浓度逐渐增大 |
| D、锌离子在锌片表面被还原 |
氯气是一种重要的工业原料.工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 |
| B、该反应利用了Cl2的强氧化性 |
| C、NH3发生还原反应 |
| D、生成1 mol N2有6 mol电子转移 |
下列说法正确的是( )
| A、含有离子键和共价键的化合物一定是离子化合物 |
| B、11H2O.12H2O.13H2O互为同位素 |
| C、目前人们已发现的元素种类数目与原子种类数目相同 |
| D、多电子原子中,在离核较近的区域内运动的电子能量较高 |