题目内容
在0.1mol?L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+.对于该平衡,下列叙述正确的是( )
| A、加入水时,CH3COOH的电离程度增大 |
| B、加入少量NaOH固体,平衡向正反应方向移动 |
| C、通入少量 HCl气体,溶液中c(H+)减小 |
| D、加入少量CH3COONa固体,平衡向正反应方向移动 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:因加入水、加热促进弱电解质的电离,加酸抑制弱酸的电离,加入与弱电解质电离出相同离子的电解质抑制电离,以此来解答.
解答:
解:A.加水促进弱电解质的电离,则电离平衡正向移动,故A正确;
B.加入少量NaOH固体,与CH3COOH电离生成的H+结合,使电离平衡正向移动,故B正确;
C.加入少量HCl溶液,c(H+)增大,则电离平衡逆向移动,故C错误;
D.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO-)增大,则电离平衡逆向移动,故D错误;
故选AB.
B.加入少量NaOH固体,与CH3COOH电离生成的H+结合,使电离平衡正向移动,故B正确;
C.加入少量HCl溶液,c(H+)增大,则电离平衡逆向移动,故C错误;
D.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO-)增大,则电离平衡逆向移动,故D错误;
故选AB.
点评:本题考查电离平衡的移动,明确影响平衡移动的因素即可解答,注意利用加水促进电离及同离子效应来分析解答.

练习册系列答案
相关题目
下列关于氯水的叙述,正确的是( )
| A、新制的氯水中只含有Cl2和H2O分子 |
| B、新制的氯水可使蓝色石蕊试纸先变蓝后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后,pH值变小,漂白能力变弱 |
下列事实中能说明亚硝酸(HNO2)是弱电解质的是( )
| A、亚硝酸不与氯化钠反应 |
| B、用HNO2溶液做导电试验,灯光较暗 |
| C、HNO2不稳定 |
| D、常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
当溶液中有大量的H+和Ba2+时,下列离子中有可能大量存在的是( )
| A、SO42- |
| B、CO32- |
| C、Cl- |
| D、OH- |
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A、Na2CO3和HCl |
| B、AlCl3和NaOH |
| C、NaAlO2和H2SO4 |
| D、Ba(HCO3)2和Ba(OH)2 |
下列说法正确的是( )
| A、S2-电子排布式 1s22s22p63s23p4 |
| B、在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 |
| C、金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 |
D、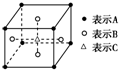 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. |