题目内容
8.研究氮及其化合物对化工生产有重要意义.(1)工业合成氨的原理为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.
下图甲表示在一定体积的密闭容器中反应时N2的物质的量浓度随时间的变化,图乙表示在其他条件不变的情况下,改变起始投料中H2与N2的物质的量之比(设为n)对该平衡的影响
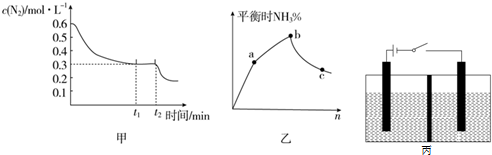
①已知图甲中0~t1 min内,v(H2)=0.03mol•L-1•min-1,则t1=30 min;若从t2 min起仅改变一个反应条件,则所改变的条件可能是降低温度或增大H2浓度(填一种即可);图乙中,b点时n=3.
②已知某温度下该反应的K=10,该温度下向容器中同时加入下列浓度的混合气体:c(H2)=0.1mol•L-1,c(N2)=0.5mol•L-1,c(NH3)=0.1mol•L-1,则在平衡建立过程中NH3的浓度变化趋势是逐渐减小(填“逐渐增大”“逐渐减小”或“恒定不变”).
(2)已知肼(N2H4)是二元弱碱,其电离是分步的,电离方程式为N2H4+H2O?N2H5++OH-、N2H5++H2O?N2H62++OH-.
(3)中国航天科技集团公司计划在2015年完成20次宇航发射任务.肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)═N2O4(l)
△H1=-195kJ•mol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g)
△H2=-534.2kJ•mol-1
写出肼和N2O4反应的热化学方程式:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ•mol-1.
(4)以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图丙所示,两端是石墨电极,中间隔板只允许离子通过,不允许水分子通过.
①已知两室加入的试剂分别是:a.硝酸溶液;b.N2O4和无水硝酸,则左室加入的试剂应为b(填代号),其电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+.
②若以甲醇燃料电池为电源进行上述电解,已知:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-651kJ•mol-1,又知甲醇和水的汽化热分别为11kJ•mol-1、44kJ•mol-1,标准状况下,该燃料电池消耗0.5mol CH3OH产生的最大电能为345.8kJ,则该电池的能量效率为95%(电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比).
分析 (1)根据速率之比等于化学计量数之比,然后根据速率的计算公式求出时间;根据影响化学平衡的因素来解答;当N2与H2的起始体积比符合方程式中化学计量数之比时,达到平衡时氨的体积分数最大;根据浓度商和化学平衡常数比较,判断化学平衡移动方向,进而判断平衡建立过程中NH3的浓度变化趋势;
(2)N2H4是二元弱碱,其性质与氨气相似,第一步电离出1个氢氧根离子和N2H5+,则第二步中N2H5+电离出1个氢氧根离子和N2H62+;
(3)依据盖斯定律,结合题干热化学方程式计算写出;
(4)①由N2O4制取N2O5需要失去电子,所以N2O5在阳极区生成,即左室为阳极,右室为阴极;
②1mol液态CH3OH变成气态CH3OH需吸热11KJ,1mol液态水变成气态水需吸热44KJ,结合CH3OH(g)的燃烧热△H为-651kJ/mol求解CH3OH(l)的燃烧热,电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比,根据液态甲醇的燃烧热计算0.5mol甲醇完全燃烧放出的热量,结合原电池产生的电能计算;
解答 解:(1)①0~t1 min内,v(H2)=0.03mol•L-1•min-1,则v(N2)=0.01mol•L-1•min-1,则v=$\frac{△c}{△t}$=$\frac{0.3mol•{L}^{-1}}{{t}_{1}min}$=0.01mol•L-1•min-1,解得t1=30 min;
从t2min起N2的浓度逐渐减小,可能是降低温度或增大H2浓度使平衡正向移动引起的;
当N2与H2的起始体积比符合方程式中化学计量数之比时,达到平衡时氨的体积分数最大,即图乙中,b点时n=3;
故答案为:30 min;降低温度或增大H2浓度;3;
②c(H2)=0.1mol•L-1,c(N2)=0.5mol•L-1,c(NH3)=0.1mol•L-1,则Qc=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$=$\frac{0.{1}^{2}}{0.5×0.{1}^{3}}$=20>10,所以反应逆向进行,NH3的浓度逐渐减小;
故答案为:逐渐减小;
(2)N2H4是二元弱碱,其电离分步进行,第一步N2H4部分电离出OH-、N2H5+,电离方程式为:N2H4+H2O?N2H5++OH-,则第二步中N2H5+在溶液中部分电离出出OH-、N2H62+,电离方程式为:N2H5++H2O?N2H62++OH-;
故答案为:N2H4+H2O?N2H5++OH-;N2H5++H2O?N2H62++OH-;
(3)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律可知反应②×2-反应①即得到反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ•mol-1;
故答案为:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ•mol-1;
(4)①装置图中与电源正极相连的电极为阳极,与电源负极相连的电极为阴极,从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,故生成N2O5的左室为阳极,右室为阴极,生成N2O5的反应式为N2O4+2HNO3-2e-=2N2O5+2H+;
故答案为:b;N2O4+2HNO3-2e-=2N2O5+2H+;
②1mol液态CH3OH变成气态CH3OH需吸热11KJ,CH3OH(g)=CH3OH(l)△H=-11KJ/mol①,1mol液态水变成气态水需吸热44KJ,H2O(g)=H2O(l)△H=-44KJ/mol②,CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-651kJ•mol-1③,则③-①+②×2得:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=(-651KJ/mol+11KJ/mol-88KJ/mol)=-728KJ/mol,理想状态下,该燃料电池消耗0.5molCH3OH(1)产生的热量为$\frac{728KJ}{2}$=364KJ,所以该燃料电池的理论效率为$\frac{345.8kJ}{364KJ}$×100%=95%;
故答案为:95%;
点评 本题考查反应速率、化学平衡、反应热的有关计算,电极反应书写,侧重于学生的分析能力和计算能力的考查,注意Qc和K之间的大小关系是判断反应方向的依据,题目难度中等.

 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结 |
A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
B | 向稀的苯酚水溶液中滴加饱和溴水 | 生成白色沉淀 | 产物三溴苯酚不溶于水 |
C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 还原性:Cl- > I- |
D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
 乙苯催化脱氢生产苯乙烯的反应:
乙苯催化脱氢生产苯乙烯的反应:
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(3)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用右图表示.[M=n(H2O)/n(乙苯)]
①比较图中A、B两点对应的平衡常数大小:KA<KB
②图中投料比(M1、M2、M3)的大小顺序为M1>M2>M3.
③某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
| A. | 前10min反应的平均速率v(C)=0.1 mol/(L•min) | |
| B. | 反应达到平衡时B的平衡浓度是1.5 mol•L-1 | |
| C. | 恒温下,将反应容器体积压缩为原来的一半,则D的平衡浓度小于1.0 mol•L-1 | |
| D. | 10 min后在容器中加入A,重新建立平衡时A的转化率一定大于50% |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
(2)不能说明该反应达到化学平衡状态的是BC.
A.正、逆反应速率相等
B.c(HI):c(H2):c(I2)=2:1:1
C.反应容器内气体的总物质的量不随时间变化
II.回答下列问题:
(3)葡萄糖在酒化酶的作用下可以得到乙醇.乙醇与乙酸反应生成有香味的产物,该反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应类型为取代反应(或酯化反应).
(4)检验葡萄糖常用新制Cu(OH)2悬浊液,将二者混合共热,观察到现象生成砖红色沉淀(或红色沉淀).
(5)乙烯通入溴的四氯化碳溶液中,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br.乙烯在一定条件下发生加聚反应生成聚乙烯,聚乙烯的结构简式为
 .
.(6)下列有关苯的叙述正确的是AB(填序号).
A.苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
B.苯分子里的6个碳原子和6个氢原子在同一个平面上
C.苯滴入溴水中,振荡后水层接近无色,是因为发生了加成反应.
 论
论 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.