题目内容
5.向2L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:mA(g)+nB(g)?pC(g)+qD(g)已知:A为有色气体;平均反应速率vC=$\frac{1}{2}$vA;反应2min时,A的浓度减少了原来的$\frac{1}{3}$,B的物质的量减少了$\frac{a}{2}$ mol,有a mol D生成.
回答下列问题:
(1)反应2min内,vA=$\frac{a}{12}$mol/(L•min),vB=$\frac{a}{8}$mol/(L•min).
(2)化学方程式中,m=2,n=3,p=1,q=6.
(3)反应平衡时,D为2a mol,则B的平衡转化率为$\frac{a}{b}$.
(4)下列选项能说明该反应已经达到平衡状态的有AEF
A.容器内的压强不再变化
B.体系的密度不变
C.容器内气体的质量不变
D.A,B,C,D的速率比恰好为其化学计量数之比
E.混合气体的颜色不再改变
F.混合气体的平均相对分子质量不再改变
G.vB(正)=vC(逆).
分析 (1)反应2min 时,A的浓度减少了$\frac{1}{3}$,则△c(A)=$\frac{1}{3}$×$\frac{amol}{2L}$=$\frac{1}{6}$amol/L,再根据v=$\frac{△c}{△t}$计算用A、B表示的反应速率;
(2)根据浓度据转化之比等于化学计量数之比;
(3)根据方程式计算消耗B的物质的量,B的转化率=$\frac{B的转化量}{B的初始量}$×100%计算.
(4)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变,以此进行判断.
解答 解:(1)反应2min 时,A的浓度减少了$\frac{1}{3}$,则△c(A)=$\frac{1}{3}$×$\frac{amol}{2L}$=$\frac{1}{6}$amol/L,则v(A)=$\frac{\frac{1}{6}mol/L}{2min}$=$\frac{a}{12}$(L•min);B的物质的量减少了$\frac{a}{2}$mol,则△c(B)=$\frac{\frac{a}{2}mol}{2L}$=$\frac{a}{4}$mol/L,v(B)=$\frac{\frac{a}{4}mol/L}{2min}$=$\frac{a}{8}$mol/(L•min);
故答案为:$\frac{a}{12}$mol/(L•min);$\frac{a}{8}$mol/(L•min);
(2)根据(1),△c(A)=$\frac{1}{6}$amol/L,△c(B)=$\frac{a}{4}$mol/L,由题vC=$\frac{1}{2}$vA;则△c(C)=$\frac{1}{2}$△c(A)=$\frac{a}{12}$
mol/L,△c(C)=$\frac{amol}{2L}$=$\frac{a}{2}$mol/L,则m:n:p:q=$\frac{1}{6}$a:$\frac{1}{4}$a:$\frac{1}{12}$a:$\frac{1}{2}$a=2:3:1:6;
故答案为:m=2,n=3,p=1,q=6;
(3)反应达到平衡时,D为2amol,由方程式2A(g)+3B(g)=C(g)+6D(g)可知消耗的B为2amol×$\frac{3}{6}$=amol,故B的转化率为$\frac{a}{b}$;
故答案为:$\frac{a}{b}$;
(4)A.反应是一个前后系数和变化的反应,当容器内的压强保持不变,证明达到了平衡,故正确,
B.容器内的密度=$\frac{m}{V}$,质量守恒,V不变化,密度始终不变,所以当密度不变,不一定平衡,故错误;
C.容器内气体的质量始终不变,不一定平衡,故错误;
D.A,B,C,D的速率比始终为其化学计量数之比,不一定平衡,故错误;
E.A为有色气体,混合气体的颜色不再改变,证明达到了平衡,故正确;
F.混合气体的平均相对分子质量不再改变,混合气体的平均相对分子质量M=$\frac{m}{n}$,质量守恒,n变化,所以当M不变,证明达到了平衡,故正确;
G.化学反应速率之比等于系数之比,vB(正)=vC(逆)不能说明正逆反应速率相等,故错误;
故答案为:AEF.
点评 本题考查化学平衡的计算、反应速率计算,题目难度中等,根据反应速率关系以及物质的量的转化关系判断反应的化学方程式是解答该题的关键.

| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
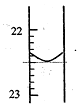 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
| 实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 (mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 20.00 | |
| 2 | 0.10 | 18.56 | 20.00 |
| 3 | 0.10 | 18.54 | 20.00 |
(2)根据上述数据,可计算出该盐酸的浓度为0.09275mol/L.
(3)在上述实验中,下列操作会造成测定结果偏高的有ABE
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失.

 .
. .
. $\stackrel{Br_{2}/CCl_{4}}{→}$
$\stackrel{Br_{2}/CCl_{4}}{→}$ $→_{△}^{NaOH/C_{2}H_{5}OH}$
$→_{△}^{NaOH/C_{2}H_{5}OH}$ .
.