题目内容
3. 乙苯催化脱氢生产苯乙烯的反应:
乙苯催化脱氢生产苯乙烯的反应:
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)一定温度下,将a mol乙苯加入体积为V L的密闭容器中,发生上述反应,反应时间与容器内气体总压强的数据如下表.
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
②计算此温度下该反应的平衡常数K$\frac{4a}{15V}$.
(3)实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用右图表示.[M=n(H2O)/n(乙苯)]
①比较图中A、B两点对应的平衡常数大小:KA<KB
②图中投料比(M1、M2、M3)的大小顺序为M1>M2>M3.
③某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2=CO+H2O,CO2+C=2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭
④有利于CO2资源利用.
分析 (1)根据△H=反应物总键能-生成物总键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,计算可得;
(2)①根据压强与气体物质的量成正比确定反应后气体的总物质的量;利用差量法计算出反应消耗乙苯的物质的量,然后计算出乙苯的转化率;
②利用三段式计算出平衡时各组分的物质的量,然后利用平衡常数表达式计算出该温度下该反应的平衡常数;
(3)①图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高;
②乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值;
③①CO2与H2反应,导致氢气浓度减低,有利于乙苯脱氢反应的化学平衡右移;
②由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少;
③由于会发生反应CO2+C═2CO,有利于减少积炭;
④CO2代替水蒸气,有利用CO2资源利用.
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1;
故答案为:+124;
(2)①容器容积固定,则容器内压强与气体的总物质的量成正比,根据表中数据可知,达到平衡时压强为反应前的1.4倍,则平衡时气体的总物质的量为:amol×1.4=1.4amol;
平衡时气体的物质的量增大:1.4amol-amol=0.4amol,设有x mol 乙苯发生转化, △n
△n
1 1 1 1
xmol 0.4amol
则:x=$\frac{0.4amol×1}{1}$=0.4amol,
所以乙苯的转化率为:$\frac{0.4amol}{amol}$×100%=40%,
故答案为:1.4a;40%;
②发生反应为
反应前(mol) a 0 0
转化(mol) 0.4a 0.4a 0.4a
平衡时(mol) 0.6a 0.4a 0.4a
则该反应的平衡常数为:K=$\frac{(0.4a÷V)•(0.4a÷V)}{(0.6a÷V)}$=$\frac{4a}{15V}$;
故答案为:$\frac{4a}{15V}$;
(3)①图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,
故答案为:<;
②乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值,M1>M2>M3,
故答案为:M1>M2>M3;
(4)①CO2与H2反应,导致氢气浓度减低,有利于乙苯脱氢反应的化学平衡右移,故正确;
②由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少,故正确;
③由于会发生反应CO2+C═2CO,有利于减少积炭,故正确;
④CO2代替水蒸气,有利用CO2资源利用,故正确;
故答案为:①②③④.
点评 本题考查反应热计算、化学平衡常数计算、反应速率及平衡移动的影响因素、对条件控制的分析评价等,注意(1)中苯环不影响计算结构、反应热有符号,学生易遗漏,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力,题目难度较大.

(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:N2(g)+6H2O(l)═4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量.化学上,规定标准状况下稳定单质的生成热为0.几种物质的生成热:NH3(g)为mkJ•mol-1,H2O(l)为nkJ•mol-1.
反应的△H=产物的生成热之和-反应物的生成热之和
②几种化学键的键能数据如下:
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
(2)二氧化硫在一定条件下可以发生如下反应:SO2(g)+NO2(g)?SO3(g)+NO(g),△H=-42kJ•mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为$\frac{10a}{3}$×100%;
③由表中数据可推知,Tl<T2(填“>”“<’’或“=”);
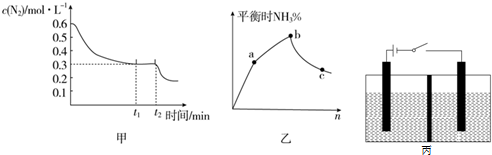
(3)对反应N2O4(g)?2NO2(g)△H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图1所示,下列说法正确的是d.

a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同),装置如图2所示,通电过程中,阳极区两种离子的放电产物会进一步发生反应,其方程式为:Cl2+CNO-+OH-→□+Cl-+CO32-+H2O(未配平).最终阴、阳两极均有无色无味气体产生.
①铁电极应连接直流电源的负极(填写电极名称).
②上述反应方程式配平后“□”内应填写N2;
③阳极上发生的电极反应为2Cl--2e-═Cl2↑和CN--2e-+2OH-=CNO-+H2O.
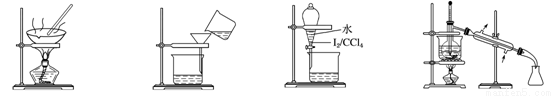
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
(1)10min内以NH3表示的平均反应速率0.005mol/(L.min);
(2)在10~20min内:NH3浓度变化的原因可能是A;
A.加了催化剂 B.缩小容器体积C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为:20-25min,第1次平衡:平衡常数K1=$\frac{(\frac{0.3mol}{2L})^{2}}{\frac{0.25mol}{2L}×(\frac{0.15mol}{2L})^{3}}$(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:分离出0.1molNH3
②达第二次平衡时,新平衡的平衡常数K2等于K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)?2NH3(g)+$\frac{3}{2}$O2(g);△H=a kJ•mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |

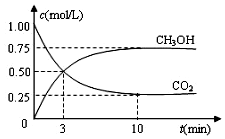 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.