题目内容
5.由N2 和H2 合成1 mol NH3 时可放出46 kJ 的热量,从手册上查出N≡N 键的键能是946 kJ/mol,H-H 键的键能是436 kJ/mol,则N-H 键的键能是( )| A. | 360 kJ/mol | B. | 263 kJ/mol | C. | 1 173 kJ/mol | D. | 391 kJ/mol |
分析 根据断裂旧键要吸热,形成新键要放热,反应热等于反应物的总键能减去生成物的总键能计算.
解答 解:N2和H2合成NH3的方程式为:N2+3H2?2NH3,由N2和H2合成1molNH3时可放出46kJ/mol的热量,则反应的△H=-2×46=-92kJ/mol,
1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×946kJ•mol-1+3×436.0kJ•mol-1=2254kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则2254-6×x=-92kJ/mol,解得x=391kJ/mol,
故选D.
点评 本题考查了键能与反应热的关系,题目难度不大,注意反应热等于反应物的总键能减去生成物的总键能.

练习册系列答案
相关题目
16.将下列各组物质按酸、碱、盐分类顺序排列,其中正确的是( )
| A. | 硫酸、纯碱、漂白粉 | B. | 硫酸、烧碱、小苏打 | ||
| C. | 硫酸氢钠、生石灰、醋酸钠 | D. | 磷酸、熟石灰、苛性钠 |
13. T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
(1)TY2是一种常用的溶剂,是非极性分子(填“极性分子”或“非极性分子”),分子中存在2个σ 键.W的最简单氢化物容易液化,理由是分子间存在氢键.
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的电负性由大到小顺序为F>O>S(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g•cm3,则晶胞边长为$\root{3}{4.72×1{0}^{-23}}$cm(用含立方根的式子表示);ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3.Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2═ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1molZ参加反应有1mol电子发生转移.
 T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:
T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表:| 元素 | 相关信息 |
| T | T元素可形成自然界硬度最大的单质 |
| W | W与T同周期,核外有一个未成对电子 |
| X | X原子的第一电离能至第四电离能分别是:I1=578kJ•mol,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z | Z的一种同位素的质量数为63,中子数为34 |
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为4Al(s)+3 O2(g)=2Al2O3(s)△H=-3352kJ/mol.
(3)基态Y原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为6.Y、氧、W元素的电负性由大到小顺序为F>O>S(用元素符号作答).
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00g•cm3,则晶胞边长为$\root{3}{4.72×1{0}^{-23}}$cm(用含立方根的式子表示);ZYO4常作电镀液,其中YO42-的空间构型是正四面体,其中Y原子的杂化轨道类型是sp3.Z的单质与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2═ZCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示正确的是AD
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1molZ参加反应有1mol电子发生转移.
10.下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
| A. | NaClO 溶液中通入过量SO2 ClO -+SO2+H2O═HClO+HSO3- | |
| B. | 甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应CH3OH+H2O-6e-═CO2↑+6H+ | |
| C. | AlCl3 溶液中投入过量Na:Al3++4Na+2H2O═AlO2 -+4Na++2H2↑ | |
| D. | 向明矾溶液中滴加Ba(OH)2,恰好使SO42- 沉淀完全:2Al3++3SO4 2-+3Ba2++6OH -═2Al(OH)3↓+3BaSO4↓ |
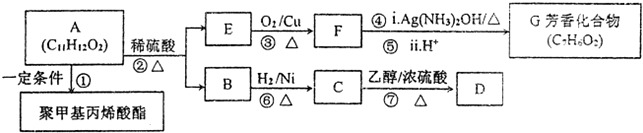
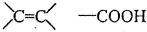 ;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂).
;检验其宫能团所用化学试剂有溴的四氯化碳(或酸性高锰酸钾溶液)、碳酸氢钠溶液(或石蕊试剂). .
. (CH3)2CHCOOCH2CH3+H2O.
(CH3)2CHCOOCH2CH3+H2O.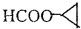 .
.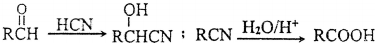
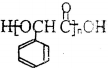 ,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.
,方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂.

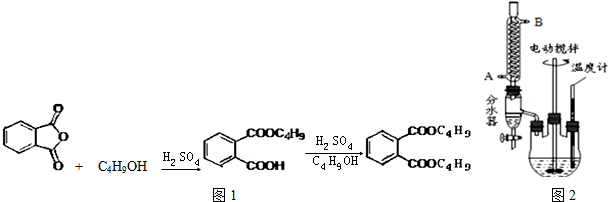
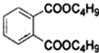 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$ +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.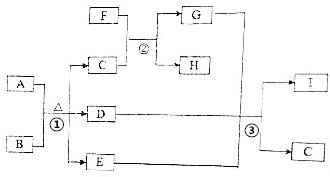 有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题:
有关物质的转化关系如图所示(部分生成物与反应条件己略去).A是常见的非金属固体单质,F是紫红色的金属单质,B、C是常见的强酸,D、G、I是常见的气体,D与I的组成元素相同,且D的相对分子质量比I的大16.E是最常见的无色液体.请回答下列问题: .
. )
) 2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1。则x和y的值分别为
2C(g)。2 s内的反应速率:v(A2)=0.5 mol·L-1·s-1,v(B2)=1.5 mol·L-1·s-1,v(C)=1 mol·L-1·s-1。则x和y的值分别为