题目内容
14.25℃时,现有浓度均为0.10mol•L-1的两种溶液:①CH3COOH溶液、②NaOH溶液.请回答:(1)溶液①的pH>(填“>”“=”或“<”)1,原因是CH3COOH在水溶液中只有部分电离成H+和CH3COO-.
(2)将等体积①和②混合,所得溶液显碱(填“酸”“碱”或“中”)性,原因是CH3COO-+H2O?CH3COOH+OH-(用离子方程式表示).
(3)向①中逐滴加入②至所得溶液pH=7的过程中(不含pH=7时的溶液),下列关系正确的是abd(填选项序号).
a.c(H+)>c(OH-)
b.c(Na+)<c(CH3COO-)
c.c(Na+)=c(CH3COO-)+c(CH3COOH)
d.c(OH-)+c(CH3COO-)=c(H+)+c(Na+)
分析 (1)CH3COOH溶液中电离出氢离子和醋酸根离子,溶液显酸性,醋酸是弱酸部分电离;
(2)将等体积①和②混合,CH3COOH溶液和NaOH溶液恰好反应生成醋酸钠溶液,溶液中醋酸根离子水解溶液显碱性;
(3)向①中逐滴加入②至所得溶液pH=7的过程中,开始醋酸多溶液显酸性,滴入氢氧化钠溶液至呈中性,醋酸略过量,得到醋酸和醋酸钠的混合溶液,恰好反应生成醋酸钠后溶液显碱性,溶液中存在物料守恒和电荷守恒.
解答 解:(1)0.10mol•L-1的CH3COOH溶液中电离出氢离子和醋酸根离子,溶液显酸性,CH3COOH?CH3COO-+H+,溶液中存在电离平衡,溶液pH>1,
故答案为:>;CH3COOH在水溶液中只有部分电离成H+和CH3COO-;
(2)将等体积①和②混合,CH3COOH溶液和NaOH溶液恰好反应生成醋酸钠溶液,溶液中醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,
故答案为:碱; CH3COO-+H2O?CH3COOH+OH-;
(3)向①中逐滴加入②至所得溶液pH=7的过程中,
a.开始阶段醋酸过量,溶液显酸性,c(H+)>c(OH-),故a正确;
b.开始阶段生成醋酸钠少,醋酸多,溶液显酸性,c(H+)>c(OH-),溶液中存在电荷守恒:c(OH-)+c(CH3COO-)=c(H+)+c(Na+),得到c(Na+)<c(CH3COO-),故b正确;
c.溶液中恰好完全反应生成醋酸钠溶液中存在守恒,c(Na+)=c(CH3COO-)+c(CH3COOH),但滴定过程溶液pH=7前,是醋酸始终过量,c(Na+)<c(CH3COO-)+c(CH3COOH),故c错误;
d.溶液中始终存在电荷守恒:c(OH-)+c(CH3COO-)=c(H+)+c(Na+),故d正确,
故答案为:abd.
点评 本题考查了盐类水解、弱电解质电离平衡、滴定过程中离子浓度大小的分析判断,掌握基础是解题关键,题目难度中等.

| A. | 第七周期元素共有50种 | |
| B. | 该元素原子的质量数是184 | |
| C. | 该元素的相对原子质量是298 | |
| D. | 该元素的原子核外有114个电子,最外层有4个电子 |
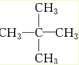
 的有机物应命名为( )
的有机物应命名为( )| A. | 2-甲基-2-乙基丁烷 | B. | 3,3-二甲基戊烷 | ||
| C. | 2-甲基-3-乙基己烷 | D. | 2,2-二甲基戊烷 |
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量盐酸,c(H+)增大,Kw不变 | |
| C. | 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低 | |
| D. | 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大 |
| A. | 化合物Z2R2中只含有离子键不含共价键 | |
| B. | 元素Y的简单气态氢化物的热稳定性比R弱 | |
| C. | 离子半径从大到小的顺序为R>Z>X>Y | |
| D. | 一定条件下,Y单质可以将X单质从其氢化物中置换出来 |
| A. | 硫酸过量或者镁带过量 | |
| B. | 液体量瓶中液体体积数就是气体的体积 | |
| C. | 须记录实验的环境温度 | |
| D. | 加入稀硫酸的量应恰好与镁带完全反应 |
 .
. A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子. .
.