题目内容
18.氧族元素的氢化物的沸点如表:| H2O | H2S | H2Se | H2Te |
| 100℃ | -60.75℃ | -41.5℃ | -1.8℃ |
| A. | 氧族元素氢化物沸点高低与范德华力的大小无关 | |
| B. | 范德华力一定随相对分子质量的增大而减小 | |
| C. | 水分子间可能还存在一种特殊的分子间作用力 | |
| D. | 水分子间存在共价键,加热时较难断裂 |
分析 氧族元素对应的氢化物的晶体都是分子晶体,决定熔沸点高低的因素是分子间作用力的大小,相对分子质量越大,分子间作用力越强,另外O的非金属性较强,对应的氢化物存在氢键,较一般分子间作用力强,水的沸点在同主族形成的氢化物中最高,以此解答该题.
解答 解:A.氧族元素对应的氢化物的晶体都是分子晶体,氢化物沸点高低与范德华力的大小有关,故A错误;
B.范德华力一定随相对分子质量的增大而增大,故B错误;
C.水的沸点较高,分子间存在氢键,故C正确;
D.水分子间不存在共价键,故D错误.
故选C.
点评 本题考查分子间作用力、氢键等知识,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质的递变、氢键以及共价键的区别,难度不大.

练习册系列答案
相关题目
19.有7.8gA和0.1molB恰好完全反应后,生成10.6gC和1.6gD,则B的摩尔质量是( )
| A. | 44g/mol | B. | 78g/mol | C. | 106g/mol | D. | 88g/mol |
9.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 向水中加入少量盐酸,c(H+)增大,Kw不变 | |
| C. | 向水中加入NaOH固体,平衡逆向移动,c(OH-)降低 | |
| D. | 向水中加入AlCl3固体,平衡正向移动,c(OH-)增大 |
13.某化学小组探究酸性条件下NO3 -、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验). (忽略氧气对反应的影响)
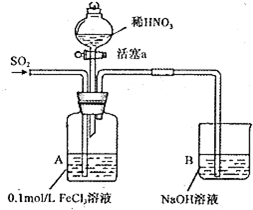
实验记录如下:
请回答下列问题:
(1)写出A装置中通入二氧化硫气体发生反应的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(2)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(3)实验III中,浅绿色溶液变为黄色的原因是在酸性条件下,NO3-把Fe2+氧化为Fe3+.(用语言叙述).
(4)实验IV若往A中通入空气,液面上方的现象是液面上方气体由无色变为红棕色.
(5)综合上述实验得岀的结论是:在酸性条件下,氧化性强弱顺序为NO3->Fe3+>SO42-.

实验记录如下:
| 实验 序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入 KSCN溶液,再加入BaCl2溶液. | 加人KSCN溶液后溶液不变色;再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A 中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| V | 取出少量A装置中的溶液,加入KSCN 溶液. | 溶液变为红色. |
(1)写出A装置中通入二氧化硫气体发生反应的离子方程式2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(2)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(3)实验III中,浅绿色溶液变为黄色的原因是在酸性条件下,NO3-把Fe2+氧化为Fe3+.(用语言叙述).
(4)实验IV若往A中通入空气,液面上方的现象是液面上方气体由无色变为红棕色.
(5)综合上述实验得岀的结论是:在酸性条件下,氧化性强弱顺序为NO3->Fe3+>SO42-.
3.短周期主族元素X、Y、Z、R原子序数依次增大且最外层电子数之和为18.Y、R同主族,短周期中Z原子半径最大,Y最外层电子数是次外层的3倍.下列推断正确的是( )
| A. | 化合物Z2R2中只含有离子键不含共价键 | |
| B. | 元素Y的简单气态氢化物的热稳定性比R弱 | |
| C. | 离子半径从大到小的顺序为R>Z>X>Y | |
| D. | 一定条件下,Y单质可以将X单质从其氢化物中置换出来 |
10.以下对未知溶液成分的检验中,结论正确的是( )
| 实验操作 | 实验现象 | 实验结论 | |
| A | 加入盐酸 | 产生无色气体 | 溶液中一定含有CO32- |
| B | 加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
| C | 加入盐酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有SO42- |
| D | 取未知溶液进行焰色反应 | 火焰显黄色 | 溶液中一定含有K+ |
| A. | A | B. | B | C. | C | D. | D |
7.提出元素周期律并首先运用元素周期律预测元素性质的科学家是( )
| A. | 戴维 | B. | 阿伏加德罗 | C. | 门捷列夫 | D. | 道尔顿 |
8.下列操作中不影响测定1mol氢气体积的实验结果的是( )
| A. | 镁带称量后,用砂纸擦去氧化膜 | B. | 硫酸稍过量 | ||
| C. | 液体量瓶的体积读数为氢气的体积 | D. | 操作中装置漏气 |
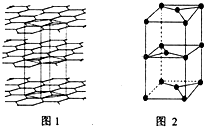 A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子.
A、B、C、D、E、F、G为前四周期元素.A、B最外层电子排布可表示为asa、bsbbpb(a≠b);C元素对应单质是空气中含量最多的物质;D的最外层电子数是内层电子数的3倍;E与D同主族,且位于D的下一周期;F与E同周期,且是本周期中电负性最大的元素:基态G原子核外电子填充在7个能级中,且价层电子均为单电子. .
.