题目内容
7.醋酸亚铁是浅绿色份末,易溶于水,可用于磷酸亚铁锂的合成,制药、印染等,可用铁与醋酸置换法、电解法或羰基铁与醋酸合成法等方法制备.回答下列问题: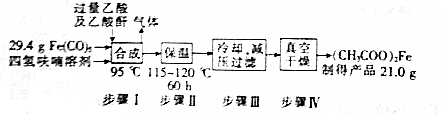
(1)铁与醋酸反应的离子方程式为Fe+2CH3COOH=2CH3COO-+Fe2++H2↑.
(2)用电解醋酸的方法制取醋酸亚铁时,阳极的材料是铁,阴极的电极反应式为2CH3COOH+2e-=2CH3COO-+H2↑.
(3)用羰基铁作铁源,实验室合成醋酸亚铁的流程如下:
①Fe(CO)5中铁元素的化合价为0
②步骤I合成反应的化学方程式为2CH3COOH+Fe(CO)5=(CH3COO)2Fe+H2↑+5CO↑
③步骤Ⅲ采用减压过滤,与普通过滤相比,其优点是过滤速度快,效果好,减少晶体损失;步骤Ⅳ采用真空燥,主要优点是防止接触到空气中的水和氧气,避免(CH3COO)2Fe被氧化.
④本次制备产率为80.46%.
分析 (1)根据金属与酸反应生成对应的盐和氢气可写出方程式Fe+2CH3COOH=2CH3COO-+Fe2++H2↑;(2)根据Fe+2CH3COOH=2CH3COO-+Fe2++H2↑,阳极发生氧化反应,由铁生成二价铁,故阳极材料为铁;阴极电极反应方程式为2CH3COOH+2e-=2CH3COO-+H2↑;
(3)①Fe(CO)5五羰基合铁,CO是中性的,就是一氧化碳,Fe是0价,这是0价过渡金属的配合物;
②由流程图知步骤I合成反应的化学方程式为2CH3COOH+Fe(CO)5=(CH3COO)2Fe+H2↑+5CO↑;
③步骤Ⅲ采用减压过滤,与普通过滤相比,其优点是过滤速度快,效果好,减少晶体损失,步骤Ⅳ采用真空燥,主要优点是防止接触到空气中的水和氧气,避免(CH3COO)2Fe被氧化;
④29.4g Fe(CO)5中含有Fe的质量为29.4×$\frac{56}{(56+28×5)}$g=8.4g,含铁的物质的量为8.4/56=0.15mol,根据铁原子守恒,理论上产生(CH3COO)2Fe的物质的量为0.15mol,折算为质量=0.15mol×175g/mol=26.1g,故本次制备产率为$\frac{21.0}{26.1}$×100%=80.46%.
解答 (1)根据金属与酸反应生成对应的盐和氢气可写出方程式Fe+2CH3COOH=2CH3COO-+Fe2++H2↑,
故答案为:;
(2)根据Fe+2CH3COOH=2CH3COO-+Fe2++H2↑,阳极发生氧化反应,由铁生成二价铁,故阳极材料为铁;阴极电极反应方程式为2CH3COOH+2e-=2CH3COO-+H2↑;
故答案为:Fe+2CH3COOH=2CH3COO-+Fe2++H2↑;
(3)①Fe(CO)5五羰基合铁,CO是中性的,就是一氧化碳,Fe是0价,这是0价过渡金属的配合物,
故答案为:0;
②由流程图知步骤I合成反应的化学方程式为2CH3COOH+Fe(CO)5=(CH3COO)2Fe+H2↑+5CO↑,
故答案为:2CH3COOH+Fe(CO)5=(CH3COO)2Fe+H2↑+5CO↑;
③步骤Ⅲ采用减压过滤,与普通过滤相比,其优点是过滤速度快,效果好,减少晶体损失,步骤Ⅳ采用真空燥,主要优点是防止接触到空气中的水和氧气,避免(CH3COO)2Fe被氧化,
故答案为:过滤速度快,效果好,减少晶体损失;防止接触到空气中的水和氧气,避免(CH3COO)2Fe被氧化;
④29.4g Fe(CO)5中含有Fe的质量为29.4×$\frac{56}{(56+28×5)}$g=8.4g,含铁的物质的量为8.4/56=0.15mol,根据铁原子守恒,理论上产生(CH3COO)2Fe的物质的量为0.15mol,折算为质量=0.15mol×175g/mol=26.1g,故本次制备产率为$\frac{21.0}{26.1}$×100%=80.46%,
故答案为:80.46%.
点评 本题以醋酸亚铁的制备为载体,主要考查了除杂提纯的基本操作、对实验步骤原理和目的分析评价、对装置的分析评价等,明确原理是解题关键,弄清所发生的化学反应及铁元素存在形态的变化.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案| A. | 丙烯 | B. | 乙烯 | C. | 苯 | D. | 酒精 |
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | F2与水反应比Cl2与水反应剧烈 | |
| C. | 铷的最高价氧化物的水化物一定是强碱 | |
| D. | 由Cl元素和S元素的最低化合价分别为-1和-2,推知元素的非金属性S>Cl |
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se是同一种核素 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |

| A. | a、b两点溶液中水的电离程度相同 | |
| B. | a、b两点溶液的pH满足:pH(a)>pH(b) | |
| C. | c点溶液满足:c(Na+)>c(CO3 2-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO3-)+2c(CO3 2-)+c(OH-) |
| 选项 | 实验 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中含Na+、不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变成血红色 | 溶液中含有Fe2+、没有Fe3+ |
| C | 向苯中滴入少量浓溴水、振荡,静置,溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  加热NaHCO3固体 | B. |  中和滴定 | ||
| C. |  用苯萃取碘水分离苯层的操作 | D. |  除去氨气中的水蒸气 |
| A. | 向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 | |
| B. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| C. | 若向0.0008 mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol•L-1) | |
| D. | 若将0.001 mol•L-1 AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |