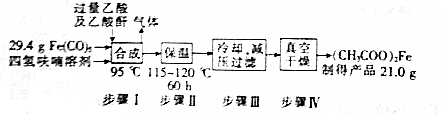
题目内容
18.将下列各种物质分别与溴水混合,并振荡,不能发生反应,溶液分层且溴水层几乎无色的是( )| A. | 丙烯 | B. | 乙烯 | C. | 苯 | D. | 酒精 |
分析 A.丙烯含碳碳双键;
B.乙烯含碳碳双键;
C.苯和水不互溶且溴在苯中的溶解度大于水中的溶解度,苯和溴不反应;
D.酒精和水互溶.
解答 解:A.丙烯能和溴发生加成反应,故A错误;
B.乙烯能和溴发生加成反应,故B错误;
C.苯和水不互溶且溴在苯中的溶解度大于水中的溶解度,苯和溴不反应,所以苯能萃取溴,使溴水层几乎无色,故C正确;
D.酒精和水互溶,所以不能萃取溴,所以溴水有颜色,故D错误.
故选C.
点评 本题考查了萃取实验,要注意实验操作中上层液体从上口流出,下层液体从下口流出;萃取是物质分离、提纯的常用物理方法,难度不大.

练习册系列答案
相关题目
8.下列物质由于发生反应,不能使溴水褪色,但能使酸性KMnO4溶液褪色的是( )
| A. | 异丁烷 | B. | 1-戊烯 | C. | 苯 | D. | 甲苯 |
9.下列各组物质中,化学键类型不同的是( )
| A. | NaCl和K2O | B. | H2O和NH3 | C. | CaF2和NaCl | D. | CCl4和Na2 SO3 |
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
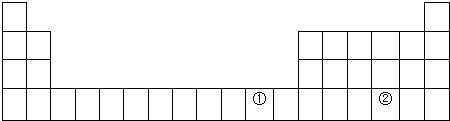
(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为
 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
13.最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似.下列说法正确的是( )
| A. | N60和N2是同素异形体 | B. | N60中氮原子之间由共价键结合 | ||
| C. | N60高温或撞击后应该生成N2 | D. | N60和14N都是氮的同位素 |
10.漂白粉在溶液中存在下列平衡体系:ClO-+H2O?HClO+OH-(正反应为吸热反应),以下措施能增强漂白粉的漂白效果的是( )
| A. | 降低温度 | B. | 加入大量的水 | ||
| C. | 加入适量盐酸 | D. | 加入适量烧碱溶液 |
8.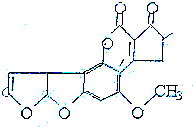 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |
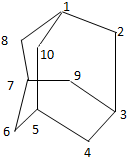 有的油田开采的石油中溶有一种碳氢化合物-金刚烷.
有的油田开采的石油中溶有一种碳氢化合物-金刚烷.