题目内容
6.已知某温度下,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12.下列关于该温度下的叙述正确的是( )| A. | 向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl) 减小 | |
| B. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| C. | 若向0.0008 mol•L-1的K2CrO4溶液中加入等体积0.002 mol•L-1的AgNO3溶液,则CrO42-完全沉淀(提示:沉淀完全c(CrO42-)≤10-5 mol•L-1) | |
| D. | 若将0.001 mol•L-1 AgNO3溶液滴入浓度均为0.001 mol•L-1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀 |
分析 A.AgCl的Ksp只与温度有关,与离子的浓度无关;
B.饱和AgCl溶液中c2(Ag+)=Ksp(AgCl)=1.56×10-10,饱和Ag2CrO4溶液中$\frac{{c}^{3}(A{g}^{+})}{2}$=Ksp(Ag2CrO4)=1×10-12,由此分析解答;
C.先让两者反应,然后根据剩余银离子,结合溶度积求CrO42-离子的浓度与1.0×10-5mol/L比较;
D.根据Ksp(AgCl)、Ksp(Ag2CrO4),计算当Cl-、CrO42-开始沉淀时c(Ag+).
解答 解:A.温度不变,则Ksp不变,故A错误;
B.饱和AgCl溶液中c2(Ag+)=Ksp(AgCl)=1.56×10-10,饱和Ag2CrO4溶液中$\frac{{c}^{3}(A{g}^{+})}{2}$=Ksp(Ag2CrO4)=1×10-12,显然后者的c(Ag+)大,故B错误;
C.两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{1×1{0}^{-12}}{(0.0002)^{2}}$=2.5×10-5mol/L>1.0×10-5mol/L,溶液中存在难溶物的溶解平衡,所以CrO42-不能完全沉淀,故C错误;
D.当Cl-开始沉淀时c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=1.8×10-7mol/L,当CrO42-开始沉淀时,(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{Cr{{O}_{4}}^{2-}}}$=4.36×10-5 mol/L,则饱和AgCl溶液中c(Ag+)比饱和Ag2CrO4溶液中c(Ag+)小,故在同浓度的KCl和K2CrO4混合溶液中滴入AgNO3溶液,先生成AgCl沉淀,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握离子之间的反应、溶度积计算等为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案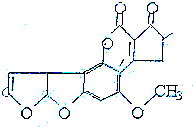 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |
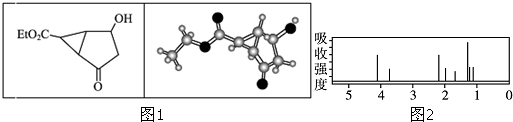
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 利用质谱法不能确定该有机物的相对分子质量 |
| 弱酸 | CH3COOH | H | HNO |
| 电离常数(25℃) | K=1.8×10-5 | K=4.×10-7 K=5.6×10-11 | K=5.0×10-4 |
(1)一定温度下,向0.1mol/LCH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)•c(H+)不变
(2)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
(3)常温下,将20mL 0.1mol•L-1 CH3COOH溶液和20mL0.1mol•L-1HNO2溶液分别与20mL 0.1 mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示,则表示CH3COOH溶液的曲线是②(填写序号);反应结束后所得两溶液中,c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”);
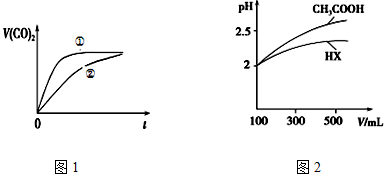
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图2所示,则HX的电离平衡常数小于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7,则NH3•H2O的电离常数Kb=1.8×10-5.
| A. | 1 mL浓氨水加水稀释至l00mL后,溶液中n(OH-)减少 | |
| B. | 室温时,0.1 mol•L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O?HCO3-+OH-向正反应方向移动,则溶液pH增大 |