题目内容
15.根据元素周期表和元素周期律,下列推断中错误的是( )| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | F2与水反应比Cl2与水反应剧烈 | |
| C. | 铷的最高价氧化物的水化物一定是强碱 | |
| D. | 由Cl元素和S元素的最低化合价分别为-1和-2,推知元素的非金属性S>Cl |
分析 A.卤族元素单质都有颜色,且其单质的颜色随着原子序数增大而加深,元素的非金属性越强,其氢化物的稳定性越强;
B.卤族元素的非金属性越强,其单质与水反应越剧烈;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.元素的非金属性强弱与得电子难易程度有关.
解答 解:A.卤族元素单质都有颜色,且其单质的颜色随着原子序数增大而加深,元素的非金属性越强,其氢化物的稳定性越强,在卤族元素中非金属性最强的是F、最弱的是At,所以它的气态氢化物很不稳定,故A正确;
B.卤族元素的非金属性越强,其单质与水反应越剧烈,非金属性F>Cl,氟气和水剧烈反应生成HF和氧气,氯气和水反应不溶于氟气剧烈,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Rb>Na,NaOH是强碱,所以RbOH也是强碱,故C正确;
D.元素的非金属性强弱与得电子难易程度有关,所以不能根据其形成的化合价高低判断金属性强弱,故D错误;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一主族元素原子结构与元素周期律的关系是解本题关键,注意规律中的反常现象,注意氟气和水反应产物,非金属性强弱与得电子多少无关,与得电子难易程度有关,易错选项是D.

练习册系列答案
相关题目
6.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素符号标出它们在周期表中对应位置(以下为周期表的一部分).
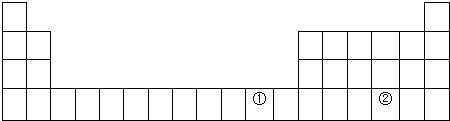
(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)①元素处于元素周期表中四周期IB族;写出该元素(Cu)单质在空气中生锈的方程式2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(3)A的离子结构示意图为
 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;(4)用一个化学方程式证明C、D元素非金属性强弱Cl2+H2S=S↓+2HCl;
(5)元素②与C的最高价含氧酸酸性由强到弱顺序为H2SO4>H2SeO4.(用化学式表示)
10.漂白粉在溶液中存在下列平衡体系:ClO-+H2O?HClO+OH-(正反应为吸热反应),以下措施能增强漂白粉的漂白效果的是( )
| A. | 降低温度 | B. | 加入大量的水 | ||
| C. | 加入适量盐酸 | D. | 加入适量烧碱溶液 |
20.下列各项叙述中正确的是( )
| A. | 在同一个电子层上运动的电子,其自旋方向肯定不同 | |
| B. | 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对 | |
| C. | 物质的键能越大,该物质本身具有的能量越低 | |
| D. | 在周期表中原子的族序数等于它的最外层电子数 |
4.(1)已知A和B元素原子的第一至第四电离能如下表所示:
据表中数据,你推断A元素原子最外层有3个电子,已知A和B是同周期元素,可以推出A的金属性<B的金属性(填“>”“<”或“=”).
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
(3)实验证明:KCl、MgO、CaO三种晶体的结构与NaCl晶体结构相似,则这三种离子晶体(不包括NaCl)熔点从高到低的顺序是:MgO>CaO>KCl.
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).
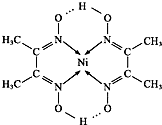
A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)紫外光的光子所具有的能量约为399kJ•mol-1.根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子.组成蛋白质的最简单的氨基酸中的碳原子杂化类型是sp2和sp3.
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,不适合作录音带磁粉原料的是V2O5.
(5)某配合物的分子结构如图所示,其分子内不含有AC(填序号).

A.离子键 B.极性键 C.金属键 D.配位键E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2.若有1mol CH4生成,则反应中有8molσ键生成.
5.某化合物的结构式 (键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm).下列关于该有机物的叙述正确的是( )
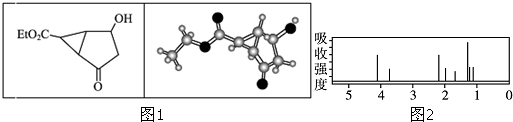

| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 利用质谱法不能确定该有机物的相对分子质量 |

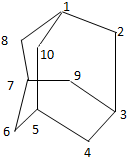 有的油田开采的石油中溶有一种碳氢化合物-金刚烷.
有的油田开采的石油中溶有一种碳氢化合物-金刚烷.