题目内容
6.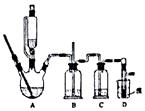 实验室制备1,2-溴乙烷的反应原理如下:
实验室制备1,2-溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2+H2O CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度(g/cm3) | 0.79 | 2.2 | 0.71 |
| 沸点(℃) | 78.5 | 132 | 34.6 |
| 熔点(℃) | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)装置B的作用是安全瓶的作用.
(3)在装置c中应加入c(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应己经结束的最简单方法是溴的颜色完全褪去.
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(6)若产物中有少量未反应的Br2,最好用b(填正确选项前的字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(7)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(8)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
分析 (1)要尽可能迅速地把反应温度提高到170℃左右,防止140℃时发生副反应生成乙醚;
(2)乙醇易溶于水;
(3)浓硫酸具有脱水性,乙醇脱水后,C与浓硫酸反应生成二氧化硫、二氧化碳;
(4)制备反应结束时,溴完全反应;
(5)1,2-二溴乙烷不溶于水,密度比水的密度大;
(6)若产物中有少量未反应的Br2,选碱性溶液除去;
(7)由表格中数据可知,乙醚与1,2-二溴乙烷的沸点差异较大;
(8)冷水冷却装置D,防止溴挥发,且温度过低,1,2-二溴乙烷易凝固.
解答 解:(1)要尽可能迅速地把反应温度提高到170℃左右,防止140℃时发生副反应生成乙醚,只有d符合,故答案为:d;
(2)装置B的作用是安全瓶的作用,故答案为:安全瓶的作用;
(3)浓硫酸具有脱水性,乙醇脱水后,C与浓硫酸反应生成二氧化硫、二氧化碳,则装置c中应加入NaOH溶液,其目的是吸收反应中可能生成的酸性气体,
故答案为:c;
(4)制备反应结束时,溴完全反应,则判断该制备反应己经结束的最简单方法是溴的颜色完全褪去,
故答案为:溴的颜色完全褪去;
(5)1,2-二溴乙烷不溶于水,密度比水的密度大,则将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层,
故答案为:下;
(6)若产物中有少量未反应的Br2,选碱性溶液除去,且不引入新杂质,只有氢氧化钠溶液洗涤合适,反应与1,2-二溴乙烷分层,分液可分离,
故答案为:b;
(7)由表格中数据可知,乙醚与1,2-二溴乙烷的沸点差异较大,则若产物中有少量副产物乙醚,可用蒸馏的方法除去,
故答案为:蒸馏;
(8)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞,
故答案为:乙烯与溴反应时放热,冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、实验操作、实验技能为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及表格数据的应用,题目难度不大.

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案| A. | 生成 SO3 为2 mol | |
| B. | 反应完全停止 | |
| C. | SO2 和 SO3物质的量之和为 2mol | |
| D. | SO2 的物质的量和SO3物质的量相等 |
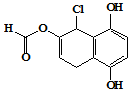
| A. | 不能发生银镜发应,能发生水解反应 | |
| B. | 1mol 该物质最多可与含2mol溴单质的浓溴水反应 | |
| C. | 1mol 该物质最多可与4molNaOH反应 | |
| D. | 与Na、NaHCO3、Na2CO3均能发生反应 |

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙使Br-全部转化为溴单质 | |
| C. | 用装置丙分液时先从下口放出水层,再从上口倒出有机层 | |
| D. | 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3 |
(1)“氯盐类”融雪剂主要成分的晶体类型为离子晶体;
(2)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(3)融雪剂对环境危害很大,如和路基上的铁等金属形成原电池,加快路面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,KCN过量时沉淀溶解,生成配合物黄血盐.
①写出亚铁离子的核外电子排布式[Ar]3d6;
②1mol CN-中π键数目为2NA .
| A. | 常温下,pH=2的硫酸溶液中,由水电离出的H+个数为10-12NA | |
| B. | 标准状况下,1.12L二氯甲烷含氯离子数为0.2NA | |
| C. | 向过量FeI2溶液中通入Cl2,当有1mol Fe2+被氧化时,转移的电子数为3NA | |
| D. | 2molNH3与3molO2在催化剂作用下加热充分反应后,所得NO分子数小于2NA |
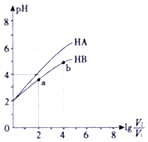 在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )
在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )| A. | a、b两点水的电离程度a小于b | |
| B. | HA、HB两种酸溶液pH相同时,c(HA)<c(HB) | |
| C. | 曲线上a、b两点$\frac{c({B}^{-})}{c(HB)•(O{H}^{-})}$一定相等 | |
| D. | 25℃时,NaA溶液中c(A-)一定大于NaB溶液中c(B-) |
| A. | 0.1molHCl气体 | B. | 0.1molNa2SO4固体 | ||
| C. | 0.2molNaOH固体 | D. | 0.1mol葡萄糖晶体 |
| A. | 含有AgBr和AgI固体的悬浊液:c(Ag+)>c(Br-)=c(I-) | |
| B. | 25℃时,0.1mol•L-1醋酸溶液PH=a,0.01mol•L-1醋酸溶液PH=b,则b=a+1 | |
| C. |  常温下,图表示以酚酞作指示剂,用0.1mol•L-1NaOH溶液滴定未知浓度的盐酸,滴定至终点时,溶液一定呈中性 | |
| D. | 向0.1mol•L-1的氨水中加入硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)减小 |